尿嘧啶和胸腺嘧啶是核酸中发现的两种嘧啶碱基。尿嘧啶仅存在于RNA中,而胸腺嘧啶仅存在于DNA中。除了尿嘧啶和胸腺嘧啶外,核酸中还有其他含氮碱基,如腺嘌呤、鸟嘌呤和胞嘧啶。尿嘧啶和胸腺嘧啶的互补碱基是腺嘌呤。它们与戊糖结合形成核苷,戊糖可以是核糖或脱氧核糖。尿嘧啶和胸腺嘧啶在C-2和C-4处都有两个酮基。
尿嘧啶是仅在RNA中发现的一种嘧啶碱基。它在嘧啶环的C-2和C-4处含有两个酮基。尿嘧啶通过糖苷键与核糖结合形成核苷尿苷。尿嘧啶在RNA中与腺嘌呤通过两个氢键配对。尿嘧啶在DNA中很少发生进化变化,增加了DNA的稳定性。尿嘧啶在植物和人类中充当变构调节剂和辅酶。它还具有一些化学性质,如氧化、烷基化和硝化反应,以及与卤素元素的反应。此外,尿嘧啶还能吸收紫外线。
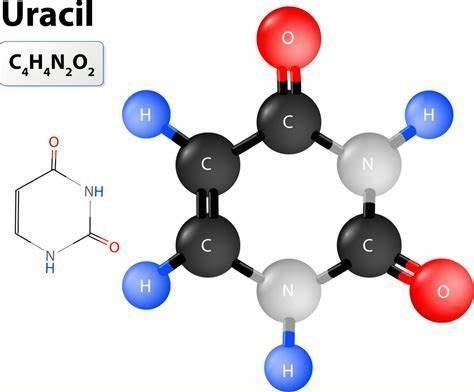
胸腺嘧啶是仅在DNA中发现的另一种嘧啶碱基。它在C-2和C-4处含有两个酮基,并在C-5处含有甲基。胸腺嘧啶与脱氧核糖形成核苷,被磷酸化为单磷酸、二磷酸和三磷酸脱氧胸苷。胸腺嘧啶在DNA双螺旋结构中与腺嘌呤通过两个氢键配对。胸腺嘧啶可以通过在嘧啶环的C-5处甲基化而得到,因此也被称为5-甲基尿嘧啶。在紫外线的作用下,胸腺嘧啶与相邻的胸腺嘧啶或胞嘧啶碱基形成二聚体,导致DNA双螺旋结构扭曲。
尿嘧啶和胸腺嘧啶是核酸中发现的两种嘧啶碱基。它们的化学结构相似,唯一的区别在于胸腺嘧啶的C-5中存在甲基。尿嘧啶仅存在于RNA中,而胸腺嘧啶仅存在于DNA中。相比之下,DNA比RNA更稳定。在癌症治疗中,常用5-氟尿嘧啶(5-fU)替代尿嘧啶和胸腺嘧啶,以抑制活跃分裂细胞中的DNA合成。
尿嘧啶是RNA特有的碱基,相当于DNA中的胸腺嘧啶(T)。是组成RNA四种构成的碱基之一。在DNA的转录时取代 DNA 中的胸腺嘧啶,与腺嘌呤配对。将尿嘧啶甲基化即得胸腺嘧啶 (T)。
胸腺嘧啶(Thymine)自胸腺中分离得到的一种嘧啶碱。易溶于热水。紫外线照射可使DNA分子中同一条链两相邻的胸腺嘧啶碱基之间形成二聚体,影响了DNA的双螺旋结构,使其复制和转录功能均受到阻碍。
尿嘧啶(简写U),是RNA的四种碱基之一,与腺嘌呤配对。在DNA转录时取代胸腺嘧啶(T)。将尿嘧啶甲基化即得胸腺嘧啶(即5-甲基尿嘧啶)。

尿嘧啶是一种弱酸,具有特定的分子式、相对分子质量和物理性质。在溶解度和燃点等方面也有具体的特点。
尿嘧啶在RNA中起着重要作用,通过与腺嘌呤结合。在DNA中,尿嘧啶被胸腺嘧啶取代,是胸腺嘧啶的去甲基化形式。其在生物进化中的作用也值得探讨。
尿嘧啶作为有机碱,在药物合成和有机合成中具有重要作用,是多种药物的中间体。
尿嘧啶的合成方法包括具体的步骤和操作条件,通过一系列反应可以得到高收率的固体尿嘧啶。
在使用尿嘧啶时,需要遵守相关的安全操作规范,避免接触皮肤和眼睛。
胸腺嘧啶(Thymine)是从胸腺中分离得到的一种嘧啶碱。它可以溶于热水。当受到紫外线照射时,胸腺嘧啶碱基会与同一条链上的相邻胸腺嘧啶碱基形成二聚体,从而影响了DNA的双螺旋结构,阻碍了DNA的复制和转录功能。
胸腺嘧啶在DNA分子中的一条链上与另一条链的腺嘌呤(A)相配对,形成两个氢键,这是维持DNA双螺旋结构稳定的重要力之一。

胸腺嘧啶是合成抗艾滋病药物AZT、DDT及相关药物的关键中间体。它可以通过化学方法合成,也可以从冰醋酸、醋酸丁酯、甲醇、甲基丙烯酸甲酯、尿素、盐酸和乙醇等原料中合成。胸腺嘧啶还是脱氧核糖核酸中的一种碱基,可以与脱氧核糖结合形成胸腺嘧啶的脱氧核苷。经过氟取代后,胸腺嘧啶的5-位甲基被氢取代,形成了三氟代胸腺嘧啶脱氧核苷,用作抗核酸代谢类抗肿瘤药物。
胸腺嘧啶核苷是一种生化试剂,用于制备生物培养基,例如HAT选择性培养基。
在单抗制备中,HAT培养基被用于选择性杀死非目标细胞。HAT培养基阻断了细胞中的DNA合成的“D途径”,而保留了应急途径或补救途径的功能。只有骨髓瘤细胞与效应B细胞相互融合形成的杂交瘤细胞,才能在HAT培养基中存活并增殖。
HAT培养基的配制:100×A(氨基喋呤)贮存液:称取1.76mg氨基喋呤溶于90ml超纯水中,滴加1mol/L的NaOH 0.5ml助溶,待完全溶解后,加1mol/L HCL 0.5ml中和,再补加超纯水到100ml。0.22um膜过滤除菌,小量分装,-20℃保存。
尿嘧啶(如图1)是常见且天然存在的嘧啶衍生物。最早发现于1900年,由酵母核素(nuclein,即为核酸)水解分离而得,可存在于牛的胸腺和脾脏、腓鱼的精液和小麦芽中。尿嘧啶为平面、不饱和的化合物,可吸收光线。

图1 尿嘧啶
性质
尿嘧啶存在于RNA中,与腺嘌呤形成硷基对,在DNA转录反应中,取代胸嘧啶。尿嘧啶甲基化后,产生胸嘧啶,以保护DNA,并提高DNA複製之效率。尿嘧啶以氢键与腺嘌呤配对,因为它含有氧和氮等电负度大的原子,是氢键接受者,而且可形成两个氢键。尿嘧啶也可以与核糖结合,形成核糖核苷──尿苷(如图2)。若有一个磷酸根连接在尿苷上,就形成尿苷5’-单磷酸。

图2 尿苷的化学结构
合成
在2009出版的某学术文件中,NASA的科学家报告了某种合成尿嘧啶的方法:在与太空相似的条件下,使嘧啶曝晒紫外光,可製造尿嘧啶。此研究显示最早自然发生的尿嘧啶之可能来源。
尿嘧啶有许多实用的实验室合成法。最简单的合成法就是把水与胞嘧啶混合,可以产生尿嘧啶与氨。
C4H5N3O + H2O → C4H4N2O2 + NH3
合成尿嘧啶最普遍的方法就是顺丁烯二酸与尿素,在发烟硫酸中进行缩合反应。
C4H4O4 + CH4N2O → C4H4N2O2 + 2 H2O + CO
硫尿嘧啶在氯乙酸水溶液中进行複分解,也是合成尿嘧啶的方法之一。此外,先用β-丙胺酸与尿素反应,可製造5,6-二氢尿嘧啶(5,6-diuracil,尿密啶的5,6两个碳原子各多接了一个氢原子);再让5,6-二氢尿嘧啶进行光脱氢反应,可合成尿嘧啶(如图3)。
?
图3 利用β-丙胺酸与尿素合成尿嘧啶
反应
尿嘧啶很容易进行一些普通的反应,包括氧化、硝化及烷基化。当有PhOH/NaOCl存在时,在UV光的蓝光区,可以看见尿嘧啶。因为有一个以上提供电子的原子团,尿嘧啶也有能力与元素态卤素反应。
尿嘧啶很容易与核糖、磷酸根进行加成反应,以便参与体内的合成及进一步反应。尿嘧啶变成尿苷、尿苷单磷酸(UMP)、尿苷二磷酸(UDP)、尿苷三磷酸(UTP)及尿苷二磷酸葡萄糖(UDP-葡萄糖)。上述每种分子都在体内合成,并各自具有专一的功能。
尿嘧啶与核糖、磷酸根键结可协助合成许多细胞运作必需的酶,这就是尿嘧啶在体内的用途。 尿嘧啶可作为异位(allosteric)调节剂,以及人体与植物中化学反应的辅酶。UMP控制植物的胺甲醯磷酸合成酶(carbamoyl phosphate synthetase)和天冬胺酸转胺甲醯酶,而UDP及UTP调节动物的CPSaseⅡ(胺甲醯磷酸合成酶Ⅱ)。UDP-葡萄糖利用醣代谢反应将肝脏及其他组织中的葡萄糖转化成半乳糖。尿嘧啶也参与多醣类的生物合成与醛糖的运输。
用途
尿嘧啶可以用于药物传递(drug delivery)及作为药剂。元素态的氟与尿嘧啶反应,生成5-氟尿嘧啶。5-氟尿嘧啶是抗癌药(抗代谢药),在複製胺基酸的过程中,5-氟尿嘧啶可冒充尿嘧啶。因为5-氟尿嘧啶的形状与尿嘧啶很相似,但化学性质不同,这种药可以抑制RNA複製酶,因而减缓RNA合成,并使癌细胞的成长停止。
参考资料:
1. http://en.wikipedia.org/wiki/Uracil
2. http://en.wikipedia.org/wiki/Drug_delivery
3. http://en.wikipedia.org/wiki/Carbamoyl_phosphate_synthetase
4. http://uracil.navajo.cz/
四氧嘧啶是一种含氧衍生物,属于嘧啶的一种。它以水合物形式存在于水溶液中。

四氧嘧啶是最早被命名的有机化合物之一。它最早由意大利化学家Luigi V. Brugnatelli在1818年分离,但是由于Brugnatelli当年即去世,并没有能够对它做进一步研究。1838年德国化学家维勒和李比希再次发现它将其命名为Alloxan。Alloxan这个词由Allantoin(尿囊素)和Oxals?ure(草酸)合并而来。
最初的四氧嘧啶由硝酸氧化尿酸制得,也可由三氧化铬氧化巴比妥酸制得。
1943年,三名英国医学研究人员Dunn,Sheehan和McLetchie在lancet上发表论文,报道了用四氧嘧啶破坏胰岛细胞,进而导致动物实验性糖尿病。
四氧嘧啶对胰脏的兰氏岛(islet of Langerhans)即胰岛(pancreas islet)的β细胞具有特殊的破坏作用,中止胰岛素的分泌,而引起动物实验性四氧嘧啶糖尿病(alloxan diabetes)。同样的作用可由葡糖胺的硝基衍生物——链脲佐菌素(streptozo ticin)的一次注射引起。
最初的四氧嘧啶由硝酸氧化尿酸制得,也可由三氧化铬氧化巴比妥酸制得。
四氢嘧啶是一种渗透性补偿性溶质,存在于中度嗜盐菌中。它在细胞内积聚可以平衡细胞的渗透压,并且在恶劣环境下对细胞提供保护作用。此外,四氢嘧啶还在化妆品中起免疫作用,能够保护皮肤免受紫外线的伤害。目前全球的供应量约为10吨,主要集中在德国,价格约为3万/公斤,产值约为3亿元。

现有的提取方法主要是通过乙醇法提取,但这种方法费时费力,不适用于大规模生产。为了解决这个问题,我们提出了一种新的四氢嘧啶提取工艺。
该工艺主要包括以下步骤:
1. 预处理:将含有四氢嘧啶物质的菌体溶液离心和干燥,然后用粉碎机将干燥后的菌体粉碎至200目以下。
2. 溶出:将粉碎后的菌体加入去离子水进行溶解,搅拌使四氢嘧啶物质溶出,然后除去上层漂浮的菌体碎片,得到含四氢嘧啶物质的溶液。
3. 脱色:将溶液进行硅藻土过滤,然后加入粉末活性炭进行脱色。
4. 电渗析脱盐:将脱色液进行电渗析脱盐,得到含四氢嘧啶物质的电渗析液。
5. 浓缩:将电渗析液进行浓缩,得到浓缩液。
6. 离子交换:将浓缩液经过阳阴离子交换树脂精制,得到离子交换液。
7. 浓缩、冷冻结晶:将离子交换液真空浓缩,然后放入冷冻干燥机中进行冷冻结晶,得到四氢嘧啶晶体。
磺胺嘧啶是一种白色或类白色的结晶或粉末,没有气味和味道,当遇到光线时会逐渐变暗。它在乙醇或丙酮中微溶,在水中不溶,在氢氧化钠试液或氨试液中易溶,在稀盐酸中溶解。
磺胺嘧啶纯品是无臭无味的白色结晶或粉末状物质,在光照射下不稳定,粉末会逐渐变暗。磺胺嘧啶与硝酸银反应可生成外用药磺胺嘧啶银,用于治疗烧伤等引起的细菌感染。
磺胺嘧啶是一种典型的口服磺酰胺类药物,通过抑制叶酸(细菌复制和生长必需物)的合成而起作用。
磺胺嘧啶适用于多种病症,包括尿道感染和敏感菌引起的中耳炎。它还可用于预防急性关节风湿病和流行性脑脊髓膜炎。磺胺嘧啶与乙胺嘧啶配合使用可预防和治疗弓形虫病。此外,它对诺卡氏菌病、软性下疳和沙眼也有疗效。磺胺嘧啶还可用于辅助治疗对氯喹具有耐受性的疟疾和各类细菌性脑膜炎。
常见的副作用包括恶心、腹泻、头痛、发烧、皮疹、抑郁和胰腺炎。
磺胺嘧啶的合成方法如下:磺胺脒与丙二醛在缩合剂甲醇钠的作用下完成环缩合反应,反应结束后,回收甲醇,再经碱液调节其pH、活性炭吸附脱色、过滤、结晶、干燥得磺胺嘧啶化合物。磺胺脒的制备方法如下:A、将NH4Cl与(NH4)2CO3按照一定比例混合后,加入活性炭催化剂,再加入双氰胺加热至熔融,在150-180℃保持30-35min;B、向以上熔融液中加入磺胺、碳酸盐继续熔融,在25min内升温到145-190℃,保持30min;C、将B步骤所得混合物中加入沸水后,将所得悬浮液冷却至40℃,过滤,得磺胺脒粗品。NH4Cl与(NH4)2CO3的摩尔比为1:1.5-1:3;磺胺脒与丙二醛摩尔比为1:1.2-2;缩合剂为25%甲醇钠的甲醇溶液,其用量为反应物磺胺脒与丙二醛总质量的1-2倍。
5-氯甲基嘧啶是一种有机化学中间体,可以通过以下步骤从5-溴嘧啶制备得到。
将5-溴嘧啶溶于THF溶液中,并在惰性氮气氛保护下加入丁基锂。在低温下搅拌反应混合物,然后加入甲酸乙酯并继续搅拌。将反应混合物洗涤并纯化,得到嘧啶-5-甲醛。
将嘧啶-5-甲醛与硼氢化钠在甲醇中反应,然后纯化得到嘧啶-5-基甲醇。
将嘧啶-5-基甲醇与亚硫酰氯反应,然后纯化得到5-(氯甲基)嘧啶。
[1] PCT Int. Appl., 2013127267, 06 Sep 2013