引言:
α-倒捻子素是一种天然存在的有机化合物,属于吡咯类生物碱,常见于多种植物中。由于其独特的化学结构和生物活性,α-倒捻子素在药物研究和植物保护领域引起了广泛关注,具有潜在的药用价值。
简介:
倒捻子素(英语:Mangostin),又称楝子素,是一种呫吨酮型色素,从倒捻子(山竹)果皮中提取得到的黄色结晶物质。在山竹中存在两种相关异构体,即α-倒捻子素和β-倒捻子素,此外成熟的山竹还会产生降倒捻子素。倒捻子素及山竹中其他多种黄酮类化合物已被研究显示具有抗氧化、抗菌、抗炎和抗癌等生物学特性。动物研究表明,倒捻子素作为中枢神经抑制剂,可导致镇静、运动能力下降和眼睑下垂现象。
1. 来源
α-倒捻子素(α-mangostin)是从藤黄科藤黄属植物山竹果壳中分离得到,具有生物活性的氧杂蔥酮化合物。山竹,又称莽吉柿、倒捻子、山竹子,是一种典型的热带水果,被誉为“果中皇后”,在中国广西、海南等地区广泛栽培。它是典型的热带雨林型果树,在 25-35 ℃、相对湿度 80%的环境下可以生长旺盛,20-25 ℃的温度范围也能满足山竹生长的基本要求。在东南亚地区山竹子的果壳可以治疗痢疾、扭伤、伤寒、溃疡、感染、消炎和杀菌。山竹果肉白色半透明,柔软多汁,香气馥郁,中医认为:山竹性偏寒凉,对虚火上升,声音沙哑,双眼红丝等症有较好的食疗效果。
目前大量研究表明,山竹具有多种药理作用,包括抗炎、抗肿瘤、抗氧化和抗菌等。这些药理活性主要归因于其果皮中的倒捻子素成分。山竹果壳提取物中除了α-倒捻子素外,还包含结构类似的β-倒捻子素、γ-倒捻子素和藤黄酮等化合物。
2. 结构特点
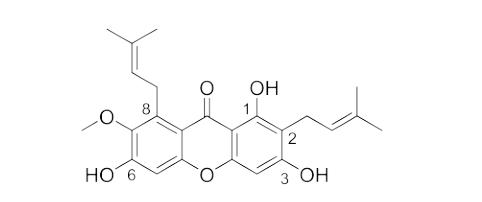
α-倒捻子素的结构特征是在C-1、C-3和C-6位置有酚羟基取代,而C-2和C-8位置是异戊二烯基的二苯并呋喃酮结构。C-3和C-6位置的酚羟基具有较高的反应活性,而C-1位置的酚羟基由于与羰基形成内分子氢键,其活性较低,因此可以通过适当的衍生化改变C-3和C-6位置的酚羟基。C-2和C-8位置的异戊二烯基也具有较高的化学反应活性,可以进行相应的衍生化反应。结构如下:
在山竹壳中,除了α-倒捻子素,主要还有β-倒捻子素和γ-倒捻子素,三种倒捻子素结构极为相近,只在个别基团上有差别,其中α-倒捻子素的含量最高,易于提取,关于它的研究也最多,其余两种含量偏低,研究也较少。
3. 理化性质
α-倒捻子素是一种从山竹壳中提取的有优秀生物活性的天然产物,α-倒捻子素的化学结构名为 1,3,6-三羟基-7-甲氧基-2,8-双(3-甲基-2-丁烯基)-9H-氧杂蒽-9-酮,化学分子式 C24H26O6,分子质量 410.6,熔点为 180-182℃,常温下外观为黄色粉末,溶解性:不溶于水,易溶于中低极性有机溶剂,如乙酸乙酯,二氯甲烷和三氯甲烷等。
参考:
[1]庞洪波,何晓非,张译文,等. α-倒捻子素对帕金森病小鼠的神经保护作用 [J]. 安徽医药, 2022, 26 (09): 1710-1714+1909.
[2]刘哲. 二甲酸钾和α-倒捻子素生产工艺研究[D]. 南昌大学, 2022. DOI:10.27232/d.cnki.gnchu.2022.004031.
[3]梁津豪. α-倒捻子素衍生物的设计、合成及其抑制磷酸二酯酶4活性研究[D]. 广州中医药大学, 2020. DOI:10.27044/d.cnki.ggzzu.2020.000935.
[4]于思. α-倒捻子素衍生物合成及其抑制磷酸二酯酶4活性研究[D]. 广州中医药大学, 2018. DOI:10.27044/d.cnki.ggzzu.2018.000209.
[5]wikipedia.org
引言:
分离提取α-倒捻子素通常采用液-液萃取、柱层析或超临界流体萃取等技术,以从植物提取物中选择性地分离出目标化合物。通过调整溶剂的极性、分离条件和操作参数,可以有效提高分离纯度和产率,为后续的分析和应用奠定基础。
简述:
α- 倒捻子素(α-Mangostin,化学式为 C24H26O6),又称为1,3,6- 三羟 基 -7- 甲氧 基 -2,8- 双(3- 甲基 -2-丁烯基)氧杂蒽 -9- 酮,最早于 19 世纪中期从山竹子(Garcinia mangostana L.)果壳中分离出,是一种最具生物活性的氧杂蒽酮类化合物。多项研究发现,α- 倒捻子素具有潜在抑制肿瘤的效应,如可抑制细胞增殖、诱导肿瘤细胞周期阻滞、诱导细胞凋亡和自噬。
α-倒捻子素分离提取
(1)主要来源
α-倒捻子素最早于十九世纪中期被 Schmid 从山竹果壳中分离出来,但由于当时检测条件有限,并未确认当时的α-倒捻子素的化学结构,直到 1958 年才由 Yates将α-倒捻子素的化学结构确定。目前从山竹果壳中提取分离也是获取α-倒捻子素的主要来源,在干山竹壳中α-倒捻子素的含量一般在 2-7%。但α-倒捻子素不仅只存在于山竹中,也可以从其他植物中获取。

(2)有机溶剂提取
α-倒捻子素常用提取溶剂为乙醇、甲醇、乙酸乙酯等,也有许多人使用二氯甲烷、三氯甲烷等毒性较大试剂进行提取。
Edison Eukun Sage 等研究比较了使用不同提取溶剂和提取方法提取的α-倒捻子素的效果。首先用甲醇 (DM) 和乙酸乙酯 (DEA)两种单一溶剂直接萃取,还有一种间接提取方式是先用甲醇萃取,再向甲醇提取液中加水,用乙酸乙酯(IEA)从甲醇水溶液中萃取α-倒捻子素,通过对实验结果的分析,他们得到了以下结论:与间接提取相比,直接提取得到的α-倒捻子素的质量更多(DM:318mg;DEA:305 mg;IEA:209 mg/5g 果壳),所以使用单一溶剂进行提取会获得更好的提取效果。
Hazuki Nerome通过专用装置用液化二甲醚从山竹壳中提取出α-倒捻子
素。
(3)共晶溶剂提取
Kamarza Mulia及其同事使用了共晶溶剂(甜菜碱作为氢键受体,1,2-丙二醇作为氢键供体)进行α-倒捻子素的提取。他们采用响应面法优化了提取工艺,并确定最佳提取条件为提取温度为56.5℃,山竹粉与溶剂的质量比为0.12,提取时间为6.9小时。在这些条件下,山竹壳中α-倒捻子素的最高提取率达到了4.2%。
(4)酶解辅助提取
唐强使用复合酶提取山竹中总氧杂蒽酮的工艺条件进行了探究。首先通过单因素实验确定了四种酶的最佳单独提取条件,然后基于此结果进行正交实验优化。最终确定的最佳提取条件为:蛋白酶、果胶酶、漆酶和纤维酶的酶加量均为0.5%,酶解温度为20℃,酶解时间为2小时,pH为5.0。在这些条件下,山竹中总氧杂蒽酮的提取率达到了10.55%。
(5)超临界萃取有研究者
用超临界二氧化碳对山竹壳萃取,使用初榨椰子油(VCO)作为共萃取剂,可以帮助促进山竹壳中倒捻子素的溶解,在探究的最佳条件(70℃,430bar, 40% VCO)下,总氧杂蒽酮的提取率最高为 31%。
(6)微波辅助提取
Ali Ghasemzadeh等人利用微波辅助提取法优化了从山竹壳中提取α-倒捻子素的工艺。他们评估了乙酸乙酯、水、乙醇和二氯甲烷四种溶剂的提取效果,结果显示乙酸乙酯表现出最佳的提取效果,其次为二氯甲烷、乙醇和水。研究还发现,在优化后的提取工艺条件下,山竹果皮提取物中α-倒捻子素和次级代谢产物的浓度显著提高,表现出更强的抗氧化和抗菌活性。
(7)高速逆流色谱法
Ricardo Felipe Alexandre de Mello等人利用HPCCC法,在甲醇/水/乙醇/己烷/甲基叔丁基醚组成的两相溶剂系统中,采用尾部洗脱模式,在流动相流速为5mL/min和800转的转速条件下,成功分离了α-倒捻子素和γ-倒捻子素,并且它们的纯度均达到93%以上。这种方法高效快捷,每次分离过程仅需35分钟完成。
(8)重结晶法
重结晶法利用不同物质在特定溶剂中溶解度差异或相同物质在不同温度下溶解度变化的原理进行分离。重结晶的优势在于有效去除杂质,但缺点是为获得更高纯度的产品通常需要多次操作,且可能存在损耗较大的问题。α-倒捻子素常用的结晶溶剂为二氯甲烷和石油醚,制备高纯度的α-倒捻子素产品通常需要多次重结晶。
参考:
[1] 唐强. 山竹果皮中α-mangostin 的酶法提取工艺及其药代动力学研究[D]. 吉林农业大学, 2013.
[2] Ali G, Hawa Z E J, Ali B, et al. Alpha-Mangostin-Rich Extracts from Mangosteen Pericarp:Optimization of Green Extraction Protocol and Evaluation of Biological Activity[J].Molecules, 2018,23(8).
[3] Kok S L, Lee W J, Smith R L, et al. Role of virgin coconut oil (VCO) as co-extractant for obtaining xanthones from mangosteen (Garcinia mangostana) pericarp with supercritical carbon dioxide extraction[J]. The Journal of Supercritical Fluids, 2021(prepublish).
[4] Wang H, Shan H, Lü H. Preparative Separation and Purification of Liquiritin and Glycyrrhizic Acid from Glycyrrhiza uralensis Fisch by High-Speed Countercurrent Chromatography.[J]. Journal of chromatographic science, 2020.
[5]刘哲. 二甲酸钾和α-倒捻子素生产工艺研究[D]. 南昌大学, 2022. DOI:10.27232/d.cnki.gnchu.2022.004031.
[6]赵斌,王翔,王小龙,等.α-倒捻子素抗肿瘤作用机制研究进展[J].中华普通外科学文献(电子版),2019,13(02):157-160.
引言:
如何提取与精制α-倒捻子素是一个关键问题,通常涉及三乙酰化的起始步骤,并随后通过溶剂萃取和重结晶步骤实现其纯化。
背景:
多项研究指出,山竹富含氧杂蒽酮类化合物,这是一类在体外系统中显示显著生物活性的特殊黄酮类化合物。在山竹的不同部位已鉴定出至少68种不同结构的氧杂蒽酮,其中约50种存在于果皮中,其含量显著高于果实的其他部位如假种皮或可食用的部分。山竹果果皮中最丰富的氧杂蒽酮是 α-倒捻子素(α-MG)和 γ-倒捻子素,目前为止研究最多的是 α-MG。其他氧杂蒽酮包括β-mangostin, mangostanol, gartanin, 8-deoxygartanin, garcinones A, B, C, D, E, mangostinone,9-hydroxycalabaxanthone, isomangostin 等。1855 年,在山竹果皮中提取的主要氧杂蒽酮中发现了 α-MG,该化合物呈淡黄色,也可以从植物的其他部分获得,例如干燥的汁液和树皮。随后,Dragendorff 和 Murakami 鉴定了 α-MG 的结构。然后由Yates 和 Stout 确定 α-MG 取代基的分子式类型和位置。
1. α-MG 提取分离方法
近年来,对于 α-MG 的提取分离方法很多,最常用的是溶剂提取法,目前已用于工业化生产:
(1)于京等人以无水乙醇为夹带剂,利用超临界萃取技术和快速制备色谱,分离得到了纯度高于 90%的 α-MG,此方法对于 α-MG 的提取分离和鉴定简单、快速、有效。
(2)张成中等人以 80%乙醇为溶剂,利用闪式提取法提取出粗提物。然后用硅胶柱色谱进行分离纯化。结果发现 α-MG 质量分数为 6.72%,此方法提取率比较高。
(3)唐强将山竹果皮粉末按一定料液比加入乙醇溶解,利用超声法进行提取,经过中心组合设计,确定最佳试验方案。超声提取是一种纯物理方法,提取效果明显优于冷浸法和回流法。而且,此方法提取率高、耗能少、操作简便。
2. 高纯度α-倒捻子素的合成工艺
夏铮等人报道了一种高纯度天然产物α-倒捻子素的合成工艺方法,包括:①以工艺提取的α-倒捻子素为起始原料,在碱的溶剂中与不同酰化试剂反应,重结晶,除去部分杂质,得到纯度较高的酚羟基取代α-倒捻子素;②合成的中间体酚羟基取代α-倒捻子素,在溶剂中通过与不同反应试剂脱去保护基,酸碱反萃,重结晶,脱色,进一步纯化,得到高纯度α-倒捻子素。该方法合成方便,且产率较高,能够满足药品对质量的要求。具体步骤如下:
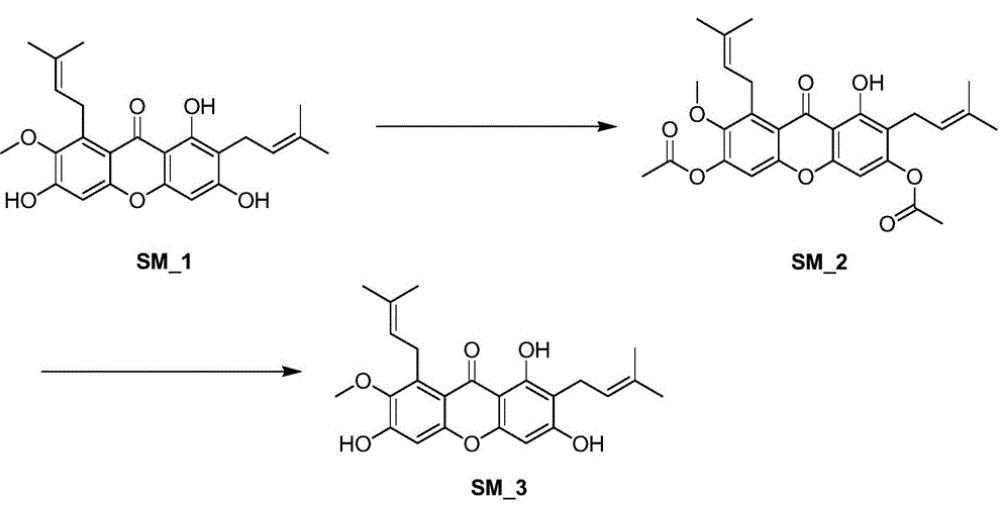
(1)上乙酰基
称取α-倒捻子素粗品SM-1(纯度>70%)250g投入5L三口瓶中,在冰浴搅拌的条件下加入1L吡啶,慢慢滴加乙酸酐(1.25L),控制釜内温度在10度以下。滴毕,加热回流3h。浓缩过量的吡啶,向浓缩液中加1.2L二氯甲烷,有机相用5%的稀盐酸600mL×2洗两次,稀盐酸层用300mL×2二氯甲烷回萃,合并有机相。有机相用饱和食盐水300mL洗,无水硫酸钠干燥,旋干得棕色油状物326g,室温冷却后变为固体。粗品用二氯甲烷/石油醚=1/1重结晶两次,干燥,得淡黄色固体SM-2220g,收率为67.2%。
(2)脱乙酰基
将三乙酰化的α-倒捻子素SM-2200g),加入2升乙醇中并搅拌。随后称取149.3克氢氧化钠配制成2mol/L溶液,加热回流反应1小时后,用600毫升二氯甲烷洗涤水相(各2次),调节pH值至中性,再用600毫升二氯甲烷萃取(各2次),然后浓缩和干燥,得到150克粗品。将150克粗品溶解于600毫升二氯甲烷中,进行活性碳脱色,过滤后浓缩,得到黄色固体。通过二氯甲烷/石油醚(1:1)混合溶剂三次重结晶,得到大量黄色固体。最后经过减压抽滤和干燥处理,得到96克黄色固体,收率为57.1%,纯度超过99.9%。
参考:
[1]付天华.α-倒捻子素抗急性肝损伤和抗抑郁作用及机制研究[D].吉林农业大学,2019.DOI:10.27163/d.cnki.gjlnu.2019.000288.
[2]杭州博麦医药科技有限公司. 高纯度α-倒捻子素的合成工艺. 2014-06-25.
非酒精性脂肪肝(NAFLD)是一种常见的肝脏疾病,与代谢性疾病密切相关。肝脏中甘油三酯(TG)水平的增加会导致胰岛素抵抗和其他代谢综合征的发生。最近的研究表明,α-倒捻子素(α-MG)是山竹果皮中含量最高的多酚类物质,具有抗癌、抗炎和抗氧化作用。然而,目前尚无关于α-MG对肝脏的作用的研究。本研究的目的是观察α-MG对肝脂肪变性和胰岛素抵抗的影响。

研究者韩国延世大学原州医学院的You Mi Kim等人将受试小鼠随机分为正常对照饮食组(RD组,n=10)、RD+α-MG组(n=10)、高脂饮食诱导的肥胖组(HFD组,n=10)及HFD+α-MG组(n=10),分别干预12周。其中α-MG的用量为50 mg/kg/d。于基线及干预结束时,采用酶联免疫法测定其血浆葡萄糖、胰岛素、总胆固醇、甘油三酯及脂联素水平;采用组织学评估法测定肝脏脂肪含量,采用免疫组化法测定肝脏组织中的固醇调节元件结合蛋白(SREBP1)及乙酰辅酶A羧化酶(ACC)含量,采用实时定量PCR测定脂肪酸合成基因标志物(SREBP1c、LPL、SCD1、C/EBPa及FasN)的mRNA表达。
与HFD组相比,HFD+α-MG组小鼠的体重及肝脏重量显著减轻,血浆葡萄糖、胰岛素及甘油三酯水平显著降低,脂联素水平显著增高,脂肪酸合成基因mRNA水平显著下调。肝脏免疫组化分析结果显示,α-MG可降低HFD小鼠肝脏组织中SREBP1及ACC的蛋白表达。此外,研究显示,α-MG还可显著改善HFD小鼠的糖耐量及胰岛素敏感性。综上可见,α-MG可延缓HFD小鼠胰岛素抵抗及肝脏脂肪变性的发生。