丁酸是一种反刍动物瘤胃和杂食动物结肠中微生物发酵碳水化合物的产物,被认为是抗生素的潜在替代物。它具有较强的杀菌作用,尤其是未被分解时的杀菌活力最好。研究发现,丁酸对沙门氏菌属具有很大的杀伤能力,与盲肠中未分解的丁酸水平有相关性。此外,丁酸还具有供能、影响内分泌、促进上皮组织生长发育、抗炎症等功能。丁酸钙作为丁酸的盐形式,已经广泛应用于动物生产中。
丁酸钙在制备动物用抗腹泻型饲料添加剂中具有一定的应用。它可以作为抗腹泻型饲料添加剂的一部分,用于控制各种类型的腹泻。丁酸钙与常规使用的包被型等剂型的丁酸钙不同,是游离型丁酸钙固体。它可以制备成预混剂,方便应用于动物养殖。丁酸钙的使用剂量范围为300-10000ppm,具体用量根据动物的生长阶段而定。
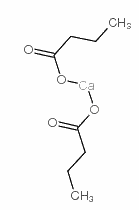
将氧化钙溶于丁酸溶液中即可得到丁酸钙。
[1] 化合物词典
[2] CN201610100119.5丁酸钙在制备动物用抗腹泻型饲料添加剂中的应用
[3] CN201410359111.1一种饲料添加剂及其应用
β-甲基-b-羟基丁酸钙,简称HMB-Ca,是一种白色固体粉末,在常温常压下易吸水并且在水中有较好的溶解性。它是β-羟基-β-甲基丁酸的钙盐形式,化学性质活泼,常用于食品添加剂和膳食添加剂等食品生产领域。

图1 β-甲基-b-羟基丁酸钙的性状图
β-甲基-b-羟基丁酸钙HMB是一种常见的补充形式,可用于促进肌肉生长、增强免疫力、增强人体固氮能力等。特别是在运动营养领域广泛应用,受到专业运动员和健身人士的欢迎。
β-甲基-b-羟基丁酸钙可用于促进肌肉生长、增强免疫力、降低胆固醇和LDL水平等。它可以添加到各种食品中,推荐量为≤3克/天。
β-甲基-b-羟基丁酸钙在美国市场上已经广泛应用于乳制品、巧克力制品、饮料等食品中。近20年来,它在运动营养领域特别受欢迎。
[1] 关于β-羟基-β-甲基丁酸钙(CaHMB)应用的科学共识[J].中国食品学报,2024,24(6):486-497.
β-羟基-β-甲基丁酸钙是一种化合物,分子式为C10H18CaO6,分子量274.32。它是一种易溶于水的白色粉末,沸点为242.8oC at 760 mmHg。β-羟基-β-甲基丁酸钙的英文名为Calcium beta-hydroxy-beta-methylbutyrate,简称HMB-Ca。它是β-羟基-β-甲基丁酸(HMB)的钙盐,而HMB是一种广泛存在于柑橘类水果、某些蔬菜如花椰菜、豆科类植物如紫苜蓿以及某些鱼类海产品中的化合物。HMB-Ca是由美国食品药品监督管理局认定的医用营养食品和特殊膳食添加剂,可以添加到饮料类、乳及乳制品、可可制品、巧克力和巧克力制品以及糖果、烘焙食品、特殊膳食食品中。

β-甲基-b-羟基丁酸钙可以通过两种方法制备。
该方法使用4-甲基-4-羟基-2-戊酮作为反应原料,水作为溶剂,通过NaOBr水溶液进行卤仿反应,然后酸化,异丁醇萃取,将异丁醇萃取物中的HMB酸与Ca(OH)2反应,制得β-羟基-β-甲基丁酸钙。这种方法具有产品纯度高、环境污染小等优点。
该方法包括以下步骤:
1)将冰醋酸、硫酸、H2O2反应,经过减压蒸馏得到过氧乙酸溶液;
2)将步骤1)得到的产物与二丙酮醇混合,加入乙酸甲酯作为溶剂反应,蒸馏收集70℃的馏分,蒸馏后的剩余物为β-羟基-β-甲基丁酸溶液;
3)将步骤2)得到的蒸馏剩余物中加入水,并加入氢氧化钠溶液将PH值调节为6.0-7.0,加热溶解后过滤,向滤液中加入氯化钙,搅拌反应,再次调节PH为6.5-7.0,析出β-羟基-β-甲基丁酸钙,过滤、烘干得到产品。
[1]李爽,吴旭丽,王慧,等.β-羟基-β-甲基丁酸钙固体饮料的研制[J].
[2]卜君.运动营养新贵β-羟基-β-甲基丁酸钙[J].食品开发, 2017(5):1.
[3]郭俊清,孙海洲,桑丹,等.过瘤胃包被亮氨酸及β-羟基-β-甲基丁酸钙对内蒙古白绒山羊免疫机能的影响[J].动物营养学报, 2010(6):6.
[4]乔璇,岳洪源,计峰,等.β-羟基β-甲基丁酸钙对肉仔鸡生长性能、屠宰性能和血液激素的影响[J].中国畜牧兽医, 2011, 38(8):5.
[5]王小曾,汤杰,杨帆.β-羟基-β-甲基丁酸钙(HMB-Ca)的制备方法:CN 02151042[P].CN 1417190 A.
[6]汤素葵.一种β-羟基-β-甲基丁酸钙的制备方法:CN201711166893.7[P].CN107954855A.
引言:
L-苏糖酸钙作为一种新型钙补充剂,近年来引起了广泛关注,其药理活性和药代动力学特性成为研究的重点。相关研究表明,L-苏糖酸钙不仅在促进钙的吸收和利用方面展现出优越性能,同时也可能通过影响成骨细胞的功能而对骨骼健康产生积极影响。
简介:
维生素 C(Vitamin C),又名抗坏血酸,是一种具有重要生理活性的物质。维生素C在体内有多种降解产物,有研究指出,维生素C的降解产物也具有一定的生理活性和药理作用,这提示人们应该关注这些降解产物的研究。L-苏糖酸(2R,3S-2,3,4-三羟基丁酸)是维生素C的主要降解产物之一,Chamberlin 等在1987年首次从人尿中将其分离出来,并确证了结构。现有的研究结果表明,L-苏糖酸能表现出一定程度的药理活性,如可增强维生素C参与合成胶原蛋白的能力,促进矿化节结的生成。
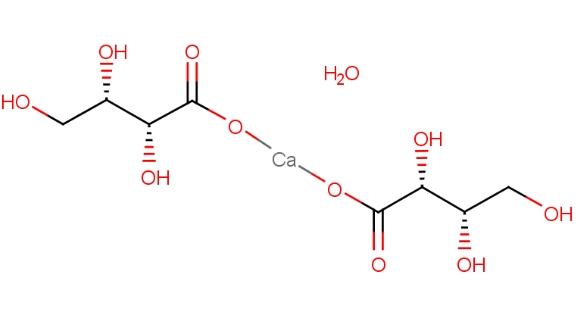
L-苏糖酸钙是L-苏糖酸的钙盐形式,首次合成于1979年,由Isbel等人通过过氧化氢氧化维生素C的方法实现。作为一种新型钙补充剂,L-苏糖酸钙的开发旨在用于临床治疗骨质疏松。L-苏糖酸是维生素C的降解产物,已有多项临床前研究和文献表明,L-苏糖酸对成骨细胞的增殖和矿化具有一定的药理活性。因此,L-苏糖酸钙在骨质疏松治疗中的药效可能源于L-苏糖酸与钙元素之间的协同作用。L-苏糖酸钙的结构如下:
1. 药理活性
以往关于 L-苏糖酸及其盐的研究主要是围绕L-苏糖酸能够促进维生素 C吸收并延长维生素C体内滞留时间这一作用而开展的。迄今为止,尽管已有研究显示L-苏糖酸钙具有影响维生素C体内代谢,从而促进成骨细胞增殖的药理作用。北京巨能亚太生命科学研究中心在国内首次合成该化合物,用于治疗骨质疏松和补钙,并向SDA(国家药品监督管理局)申报一类新药,为此在北京大学医学部、上海医科大学等研究机构进行了一系列毒理、药理及药效学试验。研究结果表明,L-苏糖酸钙能显著提高骨密度、股骨干重、灰分以及钙含量,改善骨的生物力学参数,并促进成骨细胞增殖和矿化,上调体外培养成骨细胞的α-COLImRNA 水平。同时发现L-苏糖酸钠也有相似的作用,而对照组葡萄糖酸钙和氯化钙则不存在上述作用,这说明L-苏糖酸可能不仅仅是一个简单的钙源载体,其来源和结构的特殊性(保持了维生素C的L-型光学结构)使得-苏糖酸对成骨细胞的增殖和矿化表现出直接或间接的药理活性,因此在L-苏糖酸钙对骨质疏松的整体药理活性中有可能起着重要的作用。
2. 药代动力学
在使用放射性同位素45Ca进行的不同钙盐药代动力学研究中,结果表明,在相同剂量(200mg Ca/kg体重)下,L-苏糖酸钙的全血钙浓度增加值-时间变化曲线下面积(AUC)分别是柠檬酸钙、葡萄糖酸钙和碳酸钙的1.65倍、1.77倍和9倍。这表明L-苏糖酸钙在肠道对钙的吸收和骨骼利用方面表现出优越性。此外,表中结果显示,L-苏糖酸钙的消除相半衰期最长,且达到峰值所需的时间也较长。
45Ca同位素示踪的药代动力学研究结果和非示踪法药代动力学结果是可比的,在同样给药剂量下,后者结果中同样L-苏糖酸钙的 AUC 明显大于葡萄糖酸钙、醋酸钙和碳酸钙。
另外,对剂量为1.54g/kg体重L-苏糖酸钙大鼠灌胃给药后L-苏糖酸在血中的浓度进行测定,结果表明:
(1)L-苏糖酸钙的血药浓度增加曲线与血钙浓度增加曲线的相似趋势表明,L-苏糖酸钙在吸收过程中钙离子与L-苏糖酸根离子协同被吸收。相比之下,碳酸钙等钙盐需在胃酸的作用下先分解为非碳酸形式,然后再被吸收。
(2)L-苏糖酸钙在血液中的吸收表现为峰值时血中L-苏糖酸的最高浓度为0.948mmol/L,而血钙的峰值则分别为0.618mmol/L(同位素示踪药代动力学)和0.685mmol/L(非放射性药代动力学)。这表明钙与L-苏糖酸的摩尔浓度比接近1:2,即L-苏糖酸钙中钙与L-苏糖酸的摩尔比为1:2。。
(3)L-苏糖酸的药时曲线下面积AUC为579.95,L-苏糖酸钙中钙的AUC为316.55,两者之比为1.1.8,非常接近于1:2。结合(1)、(2)的结果,从又一个角度说明L-苏糖酸钙主要以被动扩散方式吸收。
参考:
[1]王洪允. L-苏糖酸钙人体药代动力学研究及双稳定核素示踪技术测定真实钙吸收率[D]. 中国协和医科大学, 2003.
[2]仝健,牛惠生,李怀芬. L-苏糖酸钙药代动力学的~(45)Ca放射示踪研究 [J]. 同位素, 2001, (Z1): 150-154.
[3]王志文,戴向国,魏崇洁. L-苏糖酸钙防治去势雌鼠骨质疏松症的药效学研究[C]// 中国骨质疏松基金会,北京市门头沟区政府. 第一届国际骨矿研究学术会议摘要文集. 北京巨能亚太生命研究中心;, 2001: 2.
[4]于凯,寇福平,王志文. L-苏糖酸钙研究进展[C]// 中华医学会,中华预防医学会. 全国老年骨质疏松专题学术研讨会论文汇编. 巨能实业有限责任公司技术中心;巨能实业有限责任公司技术中心;巨能实业有限责任公司技术中心;, 2000: 4.
硫酸粘杆菌素(colistin)是一种对多重耐药性格兰仕阴性致病菌(如铜绿假单胞菌,Pseudomonas aeruginosa)具有特效抗性的多肽类抗生素,含有二氨基丁酸,呈碱性。在临床上常制成盐使用,目前商品化以两种形式存在,硫酸粘杆菌素是其中一种形式。硫酸粘杆菌素可用于猪、禽、牛和羊等动物,由于其抗菌作用强,残留低,不易产生耐药性,许多国家批准作为饲料添加剂或兽药。可治疗多种病菌引起的动物饲养疾病,并能促进动物生长和提高饲料利用率。

硫酸粘杆菌素的最佳配伍为杆菌肽锌、黄霉素,其次为金霉素、阿散酸。
一种硫酸粘杆菌素的生产方法,包括过滤、脱钙镁和吸附解析、浓缩、脱盐、中和、喷雾干燥等步骤。该方法具有收率高、纯化效果好且生产成本低等优点。
硫酸粘杆菌素口服难以吸收,毒性较低,不易造成药物残留,不易产生耐药性。
引言:
米格列奈作为一种新型口服降糖药,其合成方法一直是药物化学研究的热点。本文将对米格列奈的合成路线进行综述,重点探讨不同方法的优缺点,为相关研究提供参考。
简介:
米格列奈能改善2型糖尿病人进食后的血糖水平,是继瑞格列奈、那格列奈后的第三个美格列脲类药物。与瑞格列奈、那格列奈及传统磺酰脲类药物相比,此药具有作用机制新颖、起效较快、药效持续时间较短、疗效较强的特点。
合成方法:
(1)方法一
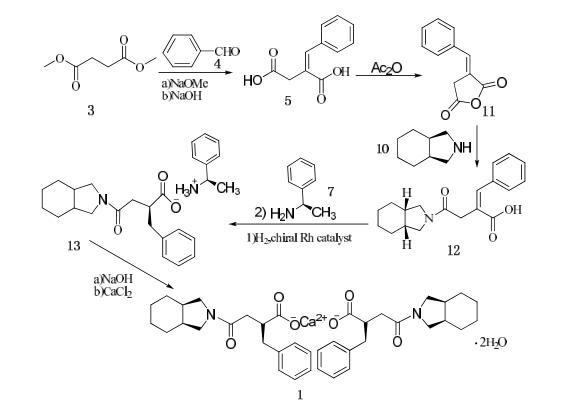
Lecouve等采用不对称氢化的方法合成米格列奈(如图所示)。以丁二酸二甲酯(3)为起始原料,在甲醇钠的甲醇溶液中与苯甲醛(4)经Stobbe缩和,水解,
酸化得亚苄基丁二酸(5)亚苄基丁二酸(5),(5)在乙酸酐的作用下环合生成亚苄基丁二酸酐(11),(11)与顺式全氢异吲哚(10)反应,得到相应的单酰胺产物(E)-2-[(顺全氢异吲哚-2-基)羰基甲基]-3-苯基丙烯酸(12),(12)用不对称氢化催化剂配合物铑/(2S,4S)-N-丁氧羰基-4-二苯基膦基-2-二苯基膦基甲基吡咯烷(Rh/(S,S)BPPM)对映体选择性还原后,得(2S)-2-苄基-3-[(顺-全氢异吲哚-2-基)羰基]丙酸(2),(2)用(R)-α-苯乙胺(7)制成相应的胺盐(13),最后制成钙盐(1)。该路线总收率为26.8%。
(2)方法二
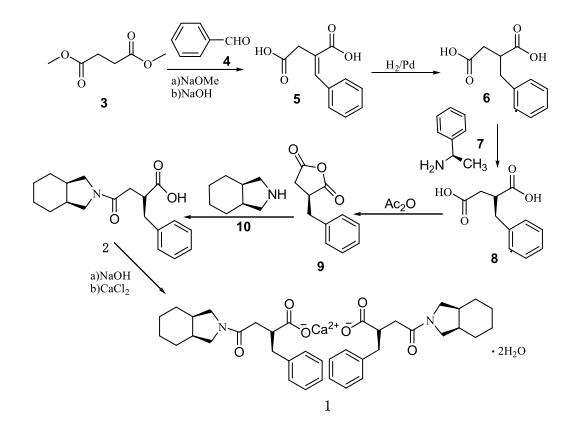
周名伟等人于2004年报道了一种以(S)-2-苄基丁二酸酐为中间体合成米格列奈的方法(如图所示)。该方法首先通过钯碳催化加氢将亚苄基丁二酸(5)转化为苄基丁二酸(6),然后使用R-(+)-α-苯乙胺(7)进行拆分,得到(S)-(-)-苄基丁二酸(8)。接着,将(8)与乙酸酐反应生成(S)-2-苄基丁二酸酐(9)。在低温下,将(9)与顺式全氢异吲哚(10)反应,通过动力学控制合成了2-(S)-苄基-4-氧代-4-(顺-全氢异吲哚-2-基)丁酸(2)。随后,在(2)的乙醇溶液中,依次滴加氢氧化钠水溶液和氯化钙水溶液,并进行剧烈搅拌,最终生成2-(S)-苄基-4-氧代-4-(顺-全氢异吲哚-2-基)丁酸钙二水合物(1)。该合成路线的收率为18.7%。
(3)方法三
Yamaguchi等人于1998年报道了通过活性酯法合成米格列奈的步骤。研究人员以苄基丁二酸(6)为原料,使用手性胺(R)-1-苯乙胺(7)进行拆分,得到所需构型的光学活性盐。经过盐酸水解,获得(S)-2-苄基丁二酸(8)。将(8)与对硝基苯酚(14)和N-羟基琥珀酸亚胺反应,制得二活性酯(15)。随后,二活性酯(15)与全氢异吲哚(10)在低温下反应,生成单酰胺单活性酯化合物(16)。该化合物在盐酸甲醇溶液中进行酯交换反应,得到(2S)-2-苄基-3-[(顺-全氢异吲哚-2-基)羰基]丙酸甲酯(17)。最后,将(17)在氢氧化钠甲醇溶液中水解,得到目标化合物(2),并进一步制成钙盐(1)。该合成路线的总收率为13.9%,所得钙盐的旋光值为[α]=+5.7o(c=1.0,MeOH)。
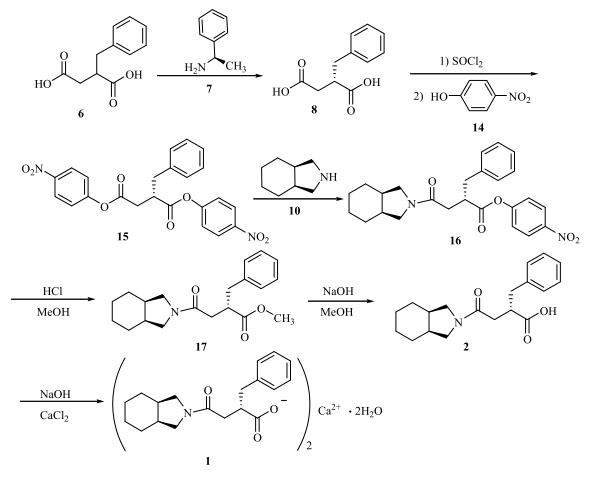
(4)方法四
苏国强等人使用L-苯丙氨酸(18)作为起始原料,通过重氮化卤代反应制得(S)-2-卤代苯丙酸(19)。在酯化反应后,得到的化合物(20)与活性次甲基如丙二腈反应生成化合物(21)。随后,化合物(21)经过水解脱羧反应得到(S)-2-苄基丁二酸(8)。在乙酸酐的作用下,化合物(8)脱水生成酸酐(9),然后与全氢异吲哚(10)反应,最终合成目标化合物(2)。该合成路线的总收率为25.8%。
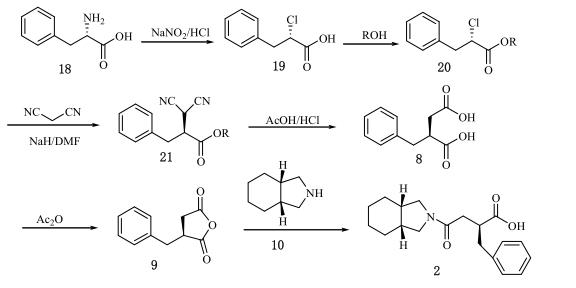
(5)方法五
杨玉社等人使用β-苯基丙酰氯(22)与(1S)-(-)-樟脑磺内酰胺(23)在碱性条件下反应,合成了N-(3-苯丙酰)莰烷-10,2-(2S)-磺内酰胺(24)。化合物(24)随后与溴乙酸叔丁酯在正丁基锂的作用下进行烷基化反应,得到N-[2-(叔丁氧羰基甲基)-3-苯丙酰]莰烷-10,2-(2S)-磺内酰胺(25)。经过保护基团的去除和酰胺化反应,得到化合物(27)。化合物(27)在碱性溶液中使用过氧化物氧化处理,去除手性助剂后,获得了化合物(2)。进一步与氯化钙反应生成米格列奈(1)的钙盐。该合成路线的总收率为51.8%,所得钙盐的比旋光度为[α]=+3.8o(c=0.6,MeOH)。
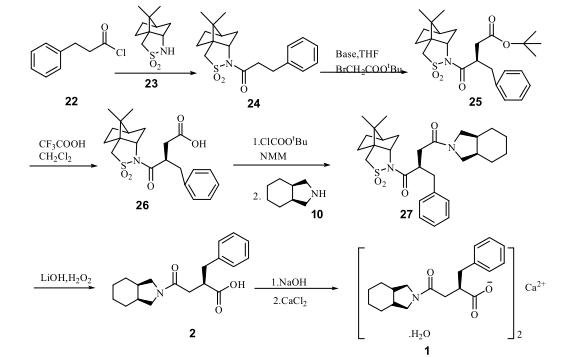
参考:
[1]周晓兰. 用HPLC法测定米格列奈异位异构体及其校正因子的结果分析 [J]. 当代医药论丛, 2014, 12 (07): 3-4.
[2]曹小辉. 米格列奈合成工艺与L-脯氨酸衍生物催化不对称Michael加成研究[D]. 天津大学, 2012.
[3]https://go.drugbank.com/salts/DBSALT001868
本文将探讨多种合成(S)-2-苄基琥珀酸的方法,分析各种合成途径的优缺点,通过对不同合成路线的比较和评估,读者将能够更全面地了解该化合物的制备过程。
背景:米格列奈钙,化学名为(+)-双[(2S,3a,7a-顺)-α-苄基六氢-γ-氧-2-异二氢吲哚丁酸]钙二水合物,是日本橘生(Kissei)制药公司开发的Ⅱ型糖尿病治疗药物,是继瑞格列奈、那格列奈后第3个美格列脲类药物。与其他美格列脲类药物及传统磺酰脲类药物相比,米格列奈的起效速度更快,半衰期更短,有利于降低糖尿病患者的餐后血糖,同时避免持续降糖引发的低血糖。
目前,文献报道的米格列奈钙合成方法多以手性起始原料(S)-2-苄基琥珀酸为主要原料,经不同的合成路线得到米格列奈钙。其中,最常用的方法为EP0967204A1报道的工艺,以(S)-2-苄基琥珀酸和顺式全氢异吲哚为原料,经缩合、成酯、水解和成盐四步反应得到米格列奈钙。该合成路线收率较高,得到产品的杂质含量低,光学纯度高,适宜于工业化生产。具体工艺路线如下:

合成:目前,(S)-2-苄基琥珀酸常用的制备方法为(如专利CN1844096、CN101270074等):以丁二酸二乙酯和苯甲醛为起始原料,经过缩合、氢化还原得到2-苄基琥珀酸,然后经拆分制得(S)-2-苄基琥珀酸。其中拆分步骤采用(R)-α-甲基苯乙胺作为拆分剂,拆分得到2-苄基琥珀酸(R)-α-甲基苯乙胺盐,然后用碱游离、酸化得到(S)-2-苄基琥珀酸。但是,该方法拆分步骤收率较低(约30%),拆分母液中尚含有约20%的(S)-2-苄基琥珀酸及50%的(R)-2-苄基琥珀酸。因此,该方法生产成本高,母液的处理费用大,环境污染严重。
1. 专利CN 105418401 A涉及一种由(R)-2-苄基琥珀酸制备(S)-2-苄基琥珀酸的方法,在含有(R)-2-苄基琥珀酸的碱性水溶液中,加入EDTA可以有效消旋。利用该发明提供的方法,可以从米格列奈钙生产过程中产生的2-苄基琥珀酸-α-苯乙胺盐的溶液出发,制得(S)-2-苄基琥珀酸,进一步提高经济效益。
2. 专利CN 111253244 B公开了一种(S)?2?苄基琥珀酸拆分母液的回收利用方法。本发明首先将拆分母液减压蒸干后,溶于碱性水溶液中,分层,水相酸化,使(S)?2?苄基琥珀酸和(R)?2?苄基琥珀酸析出,再加入低级脂肪醇ROH进行酯化反应;酯化产物再加入低级脂肪醇钠NaOR升温至回流状态下进行消旋化反应;消旋产物减压蒸馏,然后加入NaOH水溶液取代反应后酸化,使2?苄基琥珀酸的内消旋体析出,然后再进行拆分,得到(S)?2?苄基琥珀酸。本发明通过回收拆分母液实现了2?苄基琥珀酸的循环利用,提高了收率,减少了环保处理的费用。不仅降低了生产成本,而且减少环境污染,适宜于工业化生产。

参考文献:
[1] 威海迪素制药有限公司,威海迪嘉制药有限公司. 一种(S)-2-苄基琥珀酸的制备方法:CN201510749477.4[P]. 2016-03-23.
[2] 山东铂源药业有限公司. 一种(S)-2-苄基琥珀酸拆分母液的回收利用方法:CN202010161742.8[P]. 2020-10-16.
本文将探讨阿坎酸钙的企业标准,通过对企业标准的详细介绍,读者可以更好地了解阿坎酸钙产品的质量控制和规范要求。
简述:阿坎酸钙(acamprosate calcicum)又名乙酰高牛磺酸钙是一种合成的牛磺酸衍生物,其结构类似于人内源性中枢抑制性神经递质γ-氨基丁酸。其主要药理作用为戒除酒精依赖,且不具有成瘾性和滥用可能。自1989年以来已在欧洲用于治疗酒精依赖,在2004年由美国食品和药物管理局(FDA)批准用于治疗酒精依赖。
企业标准
本品为乙酰氨基丙烷磺酸钙。按干燥品计算,含C10H20CaN2O8S2 不得少于98.0-102.0%。
分子式:C10H20CaN2O8S2
分子量:400.5
【性状】 本品为白色或几乎白色粉末。本品易溶于水,几乎不溶于乙醇和二氯甲烷。
【鉴别】(1)本品红外吸收图谱应与对照的图谱一致。(中国药典2005年第二部附录ⅣC)
(2)有钙盐反应。(中国药典2005年第二部附录Ⅲ)
【检查】 溶液的澄清度与颜色 取本品5.0g,用无二氧化碳的水溶解,稀释至100ml,溶液应澄清、无色。
酸度 取溶液的澄清度与颜色项下溶液,pH 应为 5.5~7.0。(中国药典 2005 年第二部附录ⅥH)
高牛磺酸 色谱条件与系统适用性试验 用BDS十八烷基硅烷键合硅胶为填充剂;以乙腈—甲醇—0.1mol/L磷酸盐缓冲液(pH=6.5)(10:10:80)为流动相;流速为每分钟1ml;检测波长为261nm。理论塔板数按高牛磺酸衍生物峰计算不低于1500,高牛磺酸衍生物峰与荧光胺峰的分离度应符合要求。
测定法 取本品0.4g,用水溶解并稀释到20ml。取10ml,加pH10.4的硼酸缓冲液稀释到100ml。取3ml置25ml具塞试管中,加新制备的5g/l的荧光胺乙腈溶液0.15ml,立即剧烈振摇30秒;在50℃水浴中放置30min,然后放入冷水中冷却。离心,用0.45um,直径25mm的薄膜过滤悬浮物,精密量取20ul注入高效液相色谱仪,记录色谱图;另取50mg高牛磺酸对照品,用蒸馏水溶解并稀释至200ml。取0.4ml,加pH10.4的硼酸缓冲液稀释到100ml。取3.0ml同法测定,高牛磺酸的峰面积不得大于对照峰面积(0.05%)。
有关物质 取本品0.25g,加水稀释制成每1ml约含阿坎酸钙2.5mg的溶液作为供试品溶液;精密量取适量,加水稀释成每1ml中约含25ug的溶液,作为对照溶液。照含量测定项下的色谱条件,精密量取供试品溶液和对照溶液各20uL,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3.5倍。供试品溶液色谱图中如显杂质峰,各杂质峰
面积的和不得大于对照溶液的主峰面积(1.0%)。
干燥失重 取本品,在 105℃干燥至恒重,减失重量不得过 0.4%。(中国药典2005 年第二部附录ⅧL)
重金属 取本品 1.0g,加水 10ml 溶解后,依法检查(中国药典 2005 年第二部附录ⅧH 第一法),含重金属不得过百万分之十。
残留溶剂 分别精密称取甲醇 0.3g、乙醇 0.5g、二氯甲烷 0.06g 置于 100ml 量瓶中,用水稀释至刻度,摇匀,分别精密上述溶液各量取 1ml,置 10ml 量瓶中,用水稀释至刻度,摇匀,作为对照品溶液;取阿坎酸钙约 1g,精密称定,置 10ml 量瓶中,用水稀释至刻度,摇匀,既得。作为供试品溶液。分别精密量取上述两种溶液 1ul,注入气相色谱仪测定,供试品溶液如有甲醇、乙醇、二氯甲烷峰,其峰面积不得大于对照溶液主峰的峰面积。(中国药典 2005 年第二部附录ⅤE)
【含量测定】照中国药典2005年版第二部高效液相色谱法(附录ⅤD)测定。色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂;以 0.01mol/L醋酸铵溶液(用醋酸调节 pH 至 5)-甲醇(95:5)为流动相;流速为每分钟 0.5ml;检测波长为 220nm。理论塔板数按阿坎酸钙峰计算不低于 2000,阿坎酸钙峰与相邻杂质峰的分离度应符合规定。
测定法 称取本品约0.25g,精密称定,置于100mL容量瓶中,加水溶解并稀释至刻度,摇匀,精密量取20ul注入液相色谱仪,记录色谱图;另取阿坎酸钙对照品适量,同法测定,按外标法以峰面积计算供试品中C10 H20CaN2O8S2的含量。
参考文献:
[1]谭芳,张莎莎,彭彦等. RP-HPLC法测定阿坎酸钙的含量 [J]. 中国药师, 2009, 12 (12): 1777-1779.
[2]谭芳. 阿坎酸钙原料药质量研究[D]. 华中科技大学, 2009.