纳米四氧化三锰粉是通过气溶胶烧蚀法制备的,具有高纯度、小粒径、均匀分布的特点。它具有较大的比表面积和干净的表面,没有残留杂质,松装密度低,易于分散,并具有一定的磁性。

1、纳米四氧化三锰粉可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘和磁带,电话用变压器和商品质电感器,电视回归变压器,磁头,电感器,磁放大器,饱和电感器,天线棒等。
2、纳米四氧化三锰粉是合成锂离子电池正极材料锂锰氧的原料,也用于光学玻璃的制造和低温热敏电阻的制造。
3、纳米四氧化三锰粉主要应用于电子工业,是生产软磁铁氧体的原料。软磁铁氧体是由锰、锌、铁的氧化物按一定配比混合后烧结成型制造,具有狭窄的剩磁感应曲线,可以反复磁化,同时其直流电阻率很高,可以避免涡流损失。
4、纳米四氧化三锰粉可用作某些油漆或涂料的色料,含有纳米四氧化三锰的油漆或涂料喷洒在钢铁上比含二氧化钛或含氧化铁的油漆或涂料具有更好的抗腐蚀性能。
当直流电通过电解质溶液时,阳离子会移向阴极,从阴极上获得电子,而阴离子则会移向阳极,向阳极放出电子。这样,它们都会变成中性物质,即原子或原子团。这个通过电流使化合物分解的反应称为电解,而将电能转变为化学能的装置称为电解池。

当外加电压逐渐增加时,一开始并没有明显的电流,也看不出连续电解的现象。只有当两极间的电压足够大时,才会出现明显的电极反应,并且溶液中的电流随之增加。在电解过程中,Cu2+离子会移向阴极,获得电子并还原为金属铜,析出在铂极上。而阴离子则会移向阳极,由于OH-离子比SO42-离子更容易放出电子,所以阳极上会发生氧化反应,产生O2气。
为了进行电解分析,我们可以使用一个网状铂电极作为阴极,一个螺旋状铂电极作为阳极,并加入适当的阳极去极化剂。通过称量电解前和电解完毕后的铂网电极的重量(烘干后称重),我们可以精确地得到镀上去的金属铜的重量,从而计算出试液中铜的含量。这是电解分析中最常用的方法之一。

在许多简单的测定中,比如测定硫酸铜中铜的含量,普通电解分析法就可以达到精密定量分析的目的。
电解的装置如图12-20所示,电源可以使用蓄电池或硅整流器,所加电压的数值可以用伏特表指示(并联在两电极间)。通过的电流强度可以用安培表指示(串联在电路中)。搅拌器在图上没有画出,一般可以使用小马达转动阳极或应用电磁搅拌器来达到搅拌的目的。电极由铂制成,阴极制成网状,阳极制成螺旋状。

在电解时,需要加入一定比例的外加电压,该电压要大于该电解质分解的电压。有时候,外加电压甚至要比分解电压大数倍,以便加快电解的进行。随着电解过程的进行,金属离子的浓度会不断降低,同时电解池内阻也会不断增加,导致电流逐渐降低。此时,可以通过调节变阻器,增加外加电压,使电流基本上保持不变,直到电解完全结束。
这种方法只控制电流恒定,因此也被称为恒电流电解法。使用这种方法可以达到一定程度的分离效果。例如,在酸性溶液中进行电解时,可以将位于氢以下的金属相互分离,即将比氢更正的金属离子(如金、银、汞、铜、铋等)完全析出后,继续电解时只会析出氢气,而比氢更负的金属离子(如铁、锌、钴、镍、钙等)则仍然留在溶液中。
普通电解法的主要缺点是选择性差,如果实验条件控制不好,氢以下的金属仍然会产生干扰。例如,在电解含有Cu2+和Zn2+的硝酸盐溶液时,使用4安培电流,当搅拌情况良好时,Zn2+离子不会干扰Cu2+离子的测定,但在搅拌不良的情况下,少量的Zn可能会随着Cu一起电析出。因此,在使用普通电解分析法时,常常需要进行化学分离。
许多生产单位使用普通电解法进行铜及铜合金中铜的测定,铅及铅合金中铅的测定,铜镍合金以及镍电镀液中镍的测定等。
腐蚀是指(包括金属和非金属)在周围介质(水,空气,酸,碱,盐,溶剂等)作用下产生损耗与破坏的过程。循环水处理有一个很重要的任务就是防腐,循环水处理九大腐蚀机理!
01、电化学腐蚀
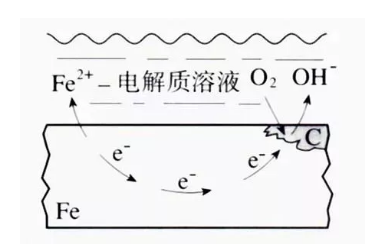
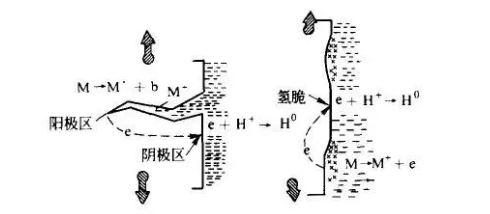
指金属表面与离子导电的介质发生电化学反应而产生的破坏。在反应过程中有电流产生,腐蚀金属表面上存在着阴极和阳极。
阳极反应是金属原子失去电子而成为离子状态转移到介质中,称为阳极氧化过程。阴极反应是介质中的去极剂吸收来自阳极的电子,称为阴极还原过程。
这两个反应是相互独立而又同时进行的,称之为一对共轭反应。由阴阳极组成了短路电池,腐蚀过程中有电流产生。如金属在海水、土壤及酸、碱、盐溶液中的腐蚀均属这一类。
02、极化和去极化作用
极化:
金属腐蚀过程中,电流在阳极部位和阴极部位间流动,这说明阳极部位和阴极部位间有电位差。如果水中不含氧,阳极腐蚀反应的电子在阴极发生以下反应:
2e+2H+→2H→H2
生成的原子态氢和气体覆盖在阴极表面,循环水处理,冷却水处理产生了与腐蚀电位相反的电压,称为的超电压,使循环水处理中的电位差起了变化,阻止了电流的流动,也就是停止了腐蚀过程的进行。
这种由于反应生成物所引起的电位差变化称为极化。循环水水处理中在腐蚀过程中起了极化作用,极化作用起了抑制腐蚀过程的作用。
去极化:
当水中有溶解氧存在时,阴极反应按下式进行:
H2+1/2O2→H2O或1/2O2+H2O+2e→2OHˉ
由于氧参加了反应,夺走了覆盖在阴极表面上的原子态氢和,因而使气体的极化作用遭到破坏。排除极化的作用称为去极化,氧在腐蚀过程中起了去极化作用,去极化作用起了助长腐蚀过程的作用。
03、电偶腐蚀
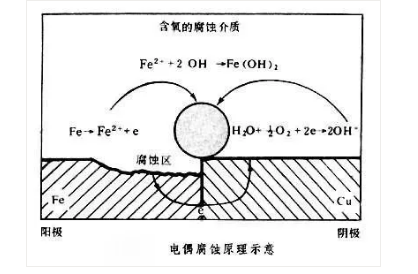
电偶腐蚀:
很多生产装置是用不同的金属或合金制造而成,这些材料是互相接触的。由于不同金属电位间存在着差异,在水溶液(电介质)中形成电偶电池,较活泼的电位较负的金属是阳极,腐蚀速度要比未偶合时高;电位较正的金属是阴极受到保护,腐蚀速度下降或停止。在系统中,常见的电偶腐蚀有铁和黄铜、铁和不锈钢、铝和钢、镑和钢、以及锌和黄铜等,不论在哪种情况下,都是前一种金属遭受腐蚀。
04、氧浓差腐蚀
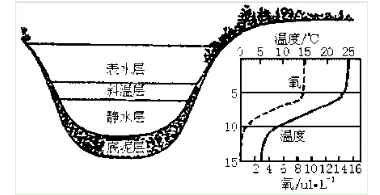
氧浓差腐蚀电池是金属在水中腐蚀时最普遍、危害最大,但又是最难防治的一种腐蚀电池。氧浓差电池是介质浓度影响阴极反应而产生最位差。最常见的氧浓差电池有两种类型,一种是在不用深度的水中由于溶解氧浓度不同而造成氧浓度梯度产生的氧浓差电池。如水线腐蚀;另一种则是冷却水系统中最常见,也是危险最大的污垢下腐蚀或叫做沉积物腐蚀。在沉积物下面形成缝隙区,在这些缝隙区的溶液中,氧要得到补充是非常困难的;而缝隙外的金属表面上的溶液,氧的供应很充分,因而缝隙外是富氧区一阴极,而缝隙内则是贫氧区一阳极。缝隙区形成的氧浓差电池造成的腐蚀部位在缝隙之内,或在沉积物下面。
05、缝隙腐蚀
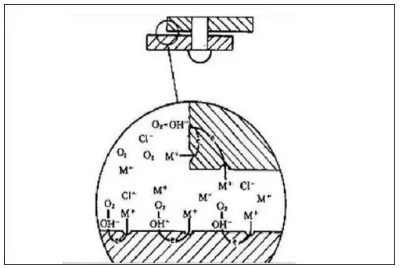
缝隙腐蚀
是金属表面被覆盖部位在某些环境中产生局部腐蚀的一种形式。大量热交换器的腐蚀穿孔,其中是最主要的原因是污垢下的腐蚀一缝隙腐蚀的一种类型。
缝隙腐蚀的产生要有两个条件:
一是要有危害性阴离子(cl)存在。
二是要有滞留的缝隙作为一个腐蚀部位,缝隙要宽到足够能使液体进入,但又要窄到能保持一个滞留区。
一般认为宽度在几千分之一英寸(1密耳以下)就会导致腐蚀,宽度在1/8英寸(0.3毫米)以上腐蚀很少产生。
06、点蚀
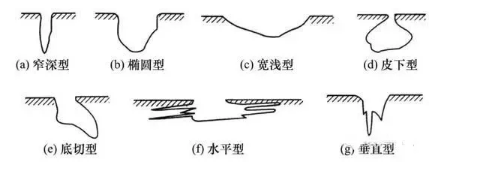
点蚀:
过去有称为坑蚀、孔蚀,但现成比较统一的叫点蚀。点蚀是一种特殊的局部腐蚀,导致在金属上产生小孔若用P表示腐蚀孔的深度,d表示腐蚀孔的宽度,当P/d≤1时称为局部腐蚀;
当P/d>1时称为点蚀。产生点蚀的原因主要是水中离子或粘泥在金属表面产生沉积,这些沉积物覆盖在金属表面使水中溶解氧和缓蚀剂不能扩散到金属表面上,从而造成局部腐蚀。
水中Cl-对点蚀也有影响,点蚀经常发生在热交热器的高温区和流速缓慢发生沉积的部位,增加水的流速有利于氧的扩散,有利于钝化膜的修补,而且亦可带走小孔上的沉积物,有利于控制点蚀的发生。
点蚀是潜伏性和破坏性最大的一种腐蚀类型。点蚀都是大阴极小阳极,有自催化特性。小孔内腐蚀,使小孔周围受到阴极保护。孔越小,阴、阳极面积比越大,穿孔越快。
点蚀发生有时往往是在材料的一侧开始,在另一侧扩大穿孔,使得检测很困难。由于点蚀极强的破坏性,现在已愈来愈引起人们的重视。
07、应力腐蚀
应力腐蚀
是指在拉应力作用下,金属在腐蚀介质中引起的破坏。这种腐蚀一般均穿过晶粒,即所谓穿晶腐蚀。应力腐蚀由残余或外加应力导致的应变和腐蚀联合作用产生的材料破坏过程。应力腐蚀导致材料的断裂称为应力腐蚀断裂。应力腐蚀一般认为有阳极溶解和氢致开裂两种。
常见应力腐蚀的机理是:
零件或构件在应力和腐蚀介质作用下,表面的氧化膜被腐蚀而受到破坏,破坏的表面和未破坏的表面分别形成阳极和阴极,阳极处的金属成为离子而被溶解,产生电流流向阴极。
由于阳极面积比阴极的小得多,阳极的电流密度很大,进一步腐蚀已破坏的表面。加上拉应力的作用,破坏处逐渐形成裂纹,裂纹随时间逐渐扩展直到断裂。这种裂纹不仅可以沿着金属晶粒边界发展,而且还能穿过晶粒发展。
08、磨蚀及空化

磨蚀
是由于腐蚀流体和金属表面间的相对运动,引起金厉的加速破坏或腐蚀.这类腐蚀常与金厉表面上的湍流程度有关。
湍流使金属表面液体的搅动比层流时更为剧烈,使金属与介质的接触更为频繁,故通常叫做湍流腐蚀。湍流腐蚀实际上是一种机械磨耗和腐蚀共同作用的结果。
磨蚀的外表特征是槽、沟、波纹、圆孔和山谷形,还常常显示有方向性。在工厂中,像泵的叶片、阀、弯管、肘管、涡轮叶片、喷嘴等流速变化较大的部位.易产生磨蚀。
空化作用
又称空泡腐蚀,它是磨蚀的一种特殊形式,是由于金厉表面附近的液体中有蒸气泡的产生和破灭所引起的。在高流速液体和压力变化的设备中易发生这类腐蚀,如水力涡轮机,船用螺旋桨、泵叶轮等。空泡腐蚀的外表十分粗糙且蚀孔分布紧密,它是腐蚀和机械作用两者引起的。
09、微生物腐蚀
微生物腐蚀
是一种特殊类型的腐蚀,它是由于微生物的直接或间接地参加了腐蚀过程所起的金属毁坏作用。微生物腐蚀一般不单独存在,往往总是和电化学腐蚀同时发生的,两者很难截然分开。
引起腐蚀的微生物一般为细菌及真菌,但也有藻类及原生动物等,在大多数场合下都可看作是各种细菌共同作用而造成危害的。微生物影响腐蚀主要是通过使电极电位和浓差电池发生变化而间接参与腐蚀作用这条途径,其方式大体分以下几类:
1.由于细菌繁殖所形成的粘泥沉积在金属表面,破坏了保护膜,构成局部电池;
2.由细菌代谢作用引起氧和其它化合物的消耗,形成通气差电池和浓差电池,在局部电池中发生去极化作用;
3.由细菌代谢产物的作用引起的;
(1)影响pH值或酸度;
(2)影响氧化还原电位;
(3)使环境的化学状况发生变化(包括氨、硝酸盐、亚硝酸盐、硫酸盐、硫化物等其他离子,在应中起催化作用);
(4)生成或消耗氧而影响氧的浓度。
微生物腐蚀是一种局部腐蚀,而且几乎都有点蚀的迹象,其危害是极其严重的。
铟是一种非常重要的战略稀散金属,广泛应用于军工、航天航空、平面显示、光电信息、太阳能电池等领域。它是制备ITO、铜铟镓硒、锑化铟、磷化铟、砷化铟等化合物半导体的重要基础材料。铟是国家《中国制造2025》中重点发展的稀有金属功能新材料之一。

A:使用5N级以上纯铟水萃成铟花。
B:将铟花用硫酸溶解,然后用高纯水稀释,得到铟电解初液。铟电解初液的电阻率应在15兆欧以上。
C:向铟电解初液中加入氯化钠和明胶,调节pH值,得到最终电解液。最终电解液中,In3+浓度为50g/L,NaCl浓度为60g/L,pH值为1.5。
将步骤一得到的电解液装入电解装置中,放入阳极和阴极,接通电源开始电解。电解过程中,控制电解液温度为15℃,电流密度为20A/m2,极距为40mm。同时,周期性取出阴极产品进行清洗和烘干,得到高纯铟产品。阳极为4N~4N5级的纯铟,阴极为钛板,导电部分为钛包铜结构。
随着生产时间延长,极距会逐渐增大,阳极逐渐溶解,导致电解槽电压升高。为保证产物铟的质量,需要适当降低电流强度。
定期检测和监控电解液的pH值。当pH值偏低时,添加固体氢氧化钠颗粒进行中和,注意搅拌均匀,避免局部电解液pH值过大。当pH值偏高时,缓慢加入硫酸,并注意搅拌均匀,避免加酸过量。
定期检测和监控铟离子浓度。当电解液铟离子浓度偏低时,适当降低电流强度,减缓贫化产生的速度,并同时补充电解原液。当电解液铟离子浓度偏高时,适当添加高纯水进行稀释。
定期检测和监控氯化钠浓度。当电解液氯化钠浓度偏低时,适当添加纯氯化钠颗粒,采用少量多次添加的方式,并充分搅拌和循环电解液,避免电解液局部浓度过大。
通过以上步骤,可以得到纯度可达99.9994%的铟产品,电流效率达到88%左右。
一种从锌冶炼的含铟物料中回收铟的方法,具有不产生砷化氢、不产生乳化现象、铟回收率高的优点。
将500L还原浸出液加热到80℃,然后缓慢加入轻质碳酸钙调浆,直至终点pH为5.0。反应1小时后进行液固分离,得到含有In4500g/t、Zn2.43wt%、Fe3.68wt%的第一石膏渣。
将第一石膏渣在75℃的温度下用锌电解废液浸出2小时,得到富铟溶液和第二石膏渣。锌电解废液的初始硫酸浓度为95g/L,富铟溶液和锌电解废液的液固比为4L/Kg。富铟溶液的主要化学成分为:Zn55.27g/L、Fe15.92g/L,Fe2+11.40g/L、Fe3+4.52g/L、In1.31g/L,H2SO473.26g/L;第二石膏渣的主要化学成分为:Zn0.35wt%,Fe0.16wt%,Cu0.005wt%,As0.06wt%,In47.25g/t。
将富铟溶液加热至70℃,加入2.9g/L的工业级还原铁粉反应30分钟后进行液固分离,得到还原后液。还原后液的主要化学成分为:Zn54.45g/L、Fe16.12g/L、Fe2+15.78g/L、Fe3+0.54g/L、In1.28g/L、H2SO471.43g/L。
将还原后液加热至50℃,加入10g/L的木炭粉搅拌反应20分钟,产出的净化液进入萃取箱,使用30%P204+70%航空煤油作为萃取剂,进行4级连续逆流铟萃取。该方法具有良好的萃取效果和较快的分相速度,且不会产生乳化现象。
[1][中国发明]CN201910802678.4制备高纯铟的方法
[2][中国发明]CN201610187701.X从锌冶炼的含铟物料中回收铟的方法
四碘化锡是一种黄至橙红色晶体,具有相对密度4.473(0℃),熔点144.5℃,沸点364.5℃,折光率2.106等特性。它可以溶于水并发生水解,也易溶于二硫化碳、苯、乙醇、乙醚、二碘甲烷等有机溶剂。四碘化锡可以通过碘化钾与四氯化锡浓溶液的反应,或锡屑与碘的二硫化碳浓溶液的反应来制备。
制备四碘化锡的主要仪器和试剂包括傅立叶变换红外光谱仪、差示扫描量热计以及锡片、碘、四氯化碳、乙酸、乙酸酐、丙酮、石油醚、苯等试剂。制备过程中,需要将干燥的锡片和研细的碘放入圆底烧瓶中,加入溶剂后进行加热回流,最后通过冷却、抽滤等步骤得到四碘化锡产品。
此外,四碘化锡的溶解度可以通过定溶质测定法在丙酮中进行测定,也可以通过定溶剂测定法在不同溶剂中进行测定。而四碘化锡的转化率可以通过倾出溶液、清洗锡片、干燥并称量剩余锡的质量来计算。
四碘化锡在材料科学领域具有广泛的应用。例如,通过将红磷、锌化银和四碘化锡反应制备二维晶体黑磷烯,可以得到一种制备工艺简单、条件温和、产量高的材料。此外,四碘化锡还可以用于制备单质磷复合聚烯烃的锂硫电池隔膜材料,该材料具有阻燃性能和离子迁移率的提高。此外,四碘化锡还可以作为制备黑磷和磷烯的原料。
[1] 化学物质辞典
[2]吴仁涛,张欣,李震.四碘化锡的制备及性质[J].临沂师范学院学报,2004(03):47-50.
[3] CN201711066858.8一种二维晶体黑磷烯的制备方法
[4] CN201811135873.8一种单质磷复合聚烯烃的锂硫电池隔膜材料及制备方法
[5]CN201610063652.9黑磷及磷烯的制备方法
连二亚硫酸钙是一种二亚硫酸盐,可以促使过氧化氢产生羟基自由基。有研究表明,它可以用于制备生物基纳米材料和锂硫电池正极材料。

一项发明提供了一种生物基纳米材料及其制备方法。为了提高生物基纳米材料制备过程中过硫酸根参与的氧化反应的效率,该方法采用了过硫酸根活化剂对过硫酸根进行活化。同时,通过利用过氧化氢参与并产生大量羟基自由基的高级氧化技术与过硫酸根参与的氧化技术的协同作用,进一步提高了制备效率。试剂中含有过渡金属离子的盐、铁单质、四甲基乙二胺、四乙酰基乙二胺、铁酸铜、活性炭、氢醌、氯代醌、亚硫酸钠、亚硫酸锂、亚硫酸钾、亚硫酸镁、亚硫酸钙、亚硫酸铵、亚硫酸、焦亚硫酸钠、焦亚硫酸锂、焦亚硫酸钾、焦亚硫酸镁、焦亚硫酸钙、焦亚硫酸铵、连二亚硫酸钠、连二亚硫酸锂、连二亚硫酸钾、连二亚硫酸镁、连二亚硫酸钙等。
一项发明报道了一种锂硫电池正极材料,包括正极活性材料、导电剂和添加剂。其中,添加剂包括连二亚硫酸盐、连四硫酸盐以及硫代金属酸盐中的至少一种。优选的连二亚硫酸盐可以是连二亚硫酸钠、连二亚硫酸钾、连二亚硫酸钙、连二亚硫酸锌中的至少一种。该发明通过向碳-硫正极中引入连二亚硫酸盐、连四硫酸盐和(M1)2M2S4(M2为金属原子W、Mo、V、Nb、Re中的一种),加快了多硫化物的电化学转化速率,减少了未参与反应而停留于电解液中的多硫化物的数量,从而抑制了"穿梭效应",提高了正极的容量和循环稳定性。
[1] [中国发明] CN201811086869.7 一种生物基纳米材料及其制备方法
[2] [中国发明,中国发明授权] CN201811342206.7 一种锂硫电池正极材料、正极及其制备和应用
氟化镁晶体具有很好的光学性能、机械性能及化学稳定性,是一种非常重要的光功能晶体材料,其用途十分广泛,常被用来制作氟化镁薄膜。

高透过率的氟化镁薄膜有很多种制备方法,例如:真空蒸发、等离子体辅助沉积、溅射方法等。在工业上,最多采用的是溅射方法,因为它能够实现在比较低的衬底温度下气相生长,且可得到大面积的薄膜。但是溅射方法也有其弊端:通常在纯Ar气氛中得到的氟化镁薄膜存在着氟空位,氟镁比失配,并且存在着很强的光学吸收。后经过研究人员的试验,脉冲激光淀积薄膜制备技术出现在人们眼前,它可以很好地保持体材料中F/Mg的化学配比,并且具有透过率高、折射率低的特点。
虽然氟化镁薄膜制备过程比较繁琐,但因其具有折射率低、透明波段宽、能隙宽、热稳定性好、机械强度大和激光损伤阈值高等优异性能,所以它成为了制备增透膜、高反膜和高损伤阈值膜的重要材料。
在玻璃基体上镀制薄膜,以增加光的透过率的实际应用中,就单层增透膜而言,最常使用的就是氟化镁,因为它不仅有合适的折射率,接近于单层膜的理论值,而且它质地坚硬,稳定性好。因此,它除了起增透的作用外,还是一层保护膜,可以增加某些玻璃的化学稳定性。
研究人员通过真空蒸发技术制备出Cu-MgF2纳米金属陶瓷薄膜。微结构分析表明该薄膜由fcc-Cu晶粒均匀分布于主要呈非晶态的氟化镁陶瓷基体中构成的,其平均粒度约为14~16nm。
减反射膜的基本原理是利用光波在减反射膜上下表面反射所产生的光程差,使得两束反射光干涉相消,从而减弱反射,增加透射。在太阳电池材料和入射光谱确定的情况下,减反射的效果决定于减反射膜的折射率及厚度。
氟化镁与硫化锌具有较为恰当的折射率,有较宽的透明范围,是较常用的减反射材料组合。研究人员利用两者特点,经过试验得出:Al0.8Ga0.2As/GaAs太阳电池表面蒸镀MgF2/ZnS双层减反射膜可明显减少太阳光的反射,增加光吸收,提高太阳电池短路电流和转换效率。
由研究人员利用混合介质理论模型和TFCalc膜系设计软件,通过双源共蒸工艺制备了MgF2-TiO2混合渐变折射率薄膜。结果发现这种氟化镁薄膜在400至800nm波段的平均反射率仅为5.56%,减反特性优于分层介质减反膜,适合于全天候的服役环境。
鋅在自然界中以化合物的形式广泛分布。主要的矿石是閃鋅矿ZnS和菱鋅矿ZnCO?。鋅矿很少单独存在,大多与鉛共生。
鉛鋅矿中鋅的含量很低,需要通过浮选法将其浓缩成含有40-60%ZnS的精矿。将精矿焙烧后转化为氧化鋅,然后与无烟煤混合,在蒸馏罐中加热至1200-1300°C使氧化鋅还原为金属鋅:
2ZnS+3O2=2ZnO+2SO2
ZnO+CO=Zn+CO2
然后进行蒸馏分离。粗鋅的纯度一般为98%,其中主要杂质是铅、鎘和铁。可以使用空蒸馏法制备纯鋅。另一种炼鋅方法是电解法,首先在约800°C的温度下氯化焙燒ZnS精矿,大部分转化为硫酸鋅,少部分转化为氧化鋅:
ZnS+2O2=ZnSO4
2ZnS+3O2=2ZnO+2SO2
得到的产物用硫酸溶解,使氧化鋅也转化为硫酸锌:
ZnO+H2SO4=ZnSO4+H2O
在硫酸锌溶液中加入鋅粉,将鎘、鈷、鎳、銅和銀等杂质置换出去,然后将溶液置于电解槽中,在阴极上析出的鋅的纯度为99.5%。
鋅的性质与用途是什么?
鋅是一种銀白色金属,略带蓝色,在常温下具有脆性,加热至100-150°C时具有延展性,在200°C以上又变得脆性甚至可以压成粉末。它可以与许多金属形成合金,其中重要的有黄銅(Cu 67%,Zn 33%)和鋁黃銅(Zn 85%, Al 5%,Cu 10%)。
鋅与含有CO2的潮湿空气接触时,会生成碱式碳酸盐:
4Zn+2O2+3H2O+CO2=ZnCO3·3Zn(OH)2
当加热到1000°C时,鋅会在空气中燃烧,发出明亮的蓝绿色火焰,形成氧化鋅ZnO。在高温下,鋅可以被水蒸汽或二氧化碳氧化:
Zn+H2O=ZnO+H2
Zn+CO2=ZnO+CO
在普通条件下,鋅与卤素反应较慢。将鋅粉与硫共热可以形成硫化鋅ZnS。在600°C下通氦气于鋅粉上,可以生成灰色的氮化鋅Zn3N2:
3Zn+2NH3=Zn3N2+3H2
纯鋅不容易与酸反应释放气体。只有含有杂质的鋅才会与酸迅速反应,因为鋅表面存在杂质,形成了局部电池。杂质作为阳极,鋅作为阴极。鋅溶解于酸中,将电子转移到阳极,使H+离子放电并释放氢气(见图20-1)。如果是纯鋅,放出的微量氢气会覆盖在鋅的表面上,阻止表面与酸接触,反应停止。为了使纯鋅在稀酸中快速溶解,可以在酸中加入几滴硫酸铜,銅被鋅置换出来,在鋅上镀上一层銅,形成局部电池,使氫离子在銅上放电并逸出,鋅可以迅速溶解。
鋅的表面容易生成碱式碳酸盐薄膜。鋅比铁更活泼,因此常在铁板上镀上一层鋅以防止生锈。如果鋅被损坏,会形成局部电池,铁作为阳极,鋅作为阴极,电子从鋅转移到铁,因此铁不会被腐蚀。
无论是纯鋅还是不纯的鋅都可以溶解于硝酸中。由于酸的浓度和反应温度不同,产物也不同。鋅可以溶解于强碱中(与鈹和鋁相同),也可以溶解于氨水中(与皱和鋁不同):
Zn+2H2O+2NaOH=Na[Zn(OH)3]+H2
Zn+2H2O+4NH3=[Zn(NH3)4](OH)2+H2
由于鋅粉是强还原剂,因此常用于有机合成、染料制备以及金和银的冶炼。