 1
1
近日,中国科学院大连化学物理研究所陈萍、郭建平研究团队在“氢化物化学固氮”研究方面取得新进展,揭示了氢化锂(LiH)光致脱氢变色现象与固氮之间的关联,并由此构筑了LiH介导的光催化合成氨过程[1]。氢化物是由一个或多个带负电的氢(H-)与电正性更强的元素或基团所组成的物质,具有高能量、强还原性、高反应性等特征。氢化物属于半导体,具有一定的吸光能力,而光和氢化物之间相互作用可能有助于介导某些小分子(如H2和N2)的化学转化,这是此研究的出发点。
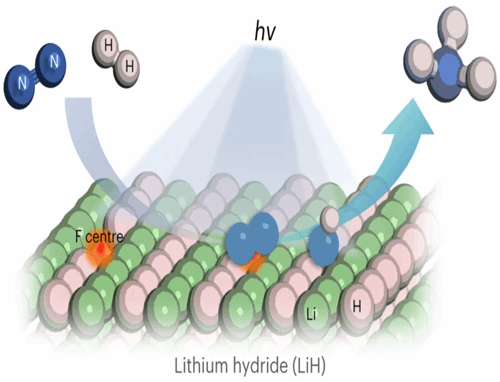
LiH的带隙大约为3.68 eV,可以吸收波长在350 nm以下的紫外光(UV)。实验发现,短暂的UV光照即可使LiH样品发生明显的变色现象,同时伴随着氢气的释放。固体漫反射紫外-可见光谱表征结果显示LiH在UV照射下出现了一个以650 nm为中心的吸光带以及尖锐而对称的顺磁共振波谱(EPR)信号。这说明LiH在光照脱氢后,其表面可能生成了氢空位结构(F心)。作者进一步计算了具有两个氢空位的LiH(100)晶面的态密度(Density of states, DOS),发现电子更倾向于分布在氢空位中形成表面F心,从而在导带和价带之间形成了主要由Li的2p轨道组成的缺陷态。这一缺陷态的产生解释了LiH样品光致变色并可以吸收可见光(400-800 nm)的实验现象。
LiH的光解与常见氧化物和氮化物半导体在光照下的表现存在本质差异。传统光催化剂光照产生的载流子容易发生复合而影响光催化效率。而LiH在光照过程中空穴可以氧化负氢并放氢形成氢空位,产生的光生电子则能储存在氢空位中,形成F心从而使表面呈现富电子的状态,这对后续化学转化过程具有重要作用。
[1] Guan, Y., Wen, H., Cui, K. et al. Light-driven ammonia synthesis under mild conditions using lithium hydride. Nat. Chem. 16, 373–379 (2024). https://doi.org/10.1038/s41557-023-01395-8