三甲基硅咪唑是一种硅烷化试剂,具有一定的吸湿性,可以与水反应。它能够快速、高效地与羟基和羧基发生反应,多用于有机合成基础研究和药物分子结构修饰与合成。
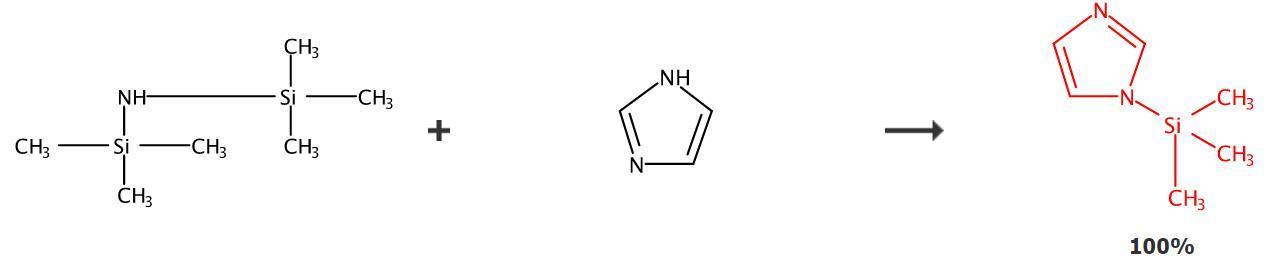
图1 三甲基硅咪唑的合成路线
将咪唑、硫酸壳聚糖纳米杂化物和六甲基二硅氮烷加入干燥的圆底烧瓶中,加热至90℃,搅拌反应7分钟,直到达到透明液体。反应结束后过滤除去催化剂,浓缩蒸发滤液,即可得到三甲基硅咪唑。
三甲基硅咪唑在有机化学中是一种常用的硅烷化试剂,可以用于制备既含有羟基又含有氨基的化合物的多重衍生物。此外,它还可以和三氯氧膦进行反应,将咪唑基团转移至膦中心生成三咪唑氧膦化合物。该化合物在医药生产领域有广泛应用,例如作为抗菌素的合成中间体。
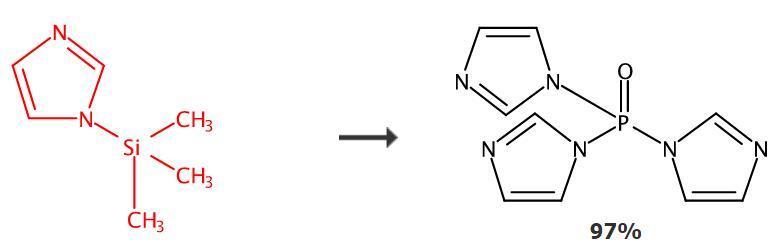
图2 三甲基硅咪唑的应用
在氩气环境下,用氧氯化磷和三甲基硅基咪唑反应,经过浓缩和结晶得到目标产物分子。
[1] Behrouz, Somayeh et al Chemical Papers, 74(1), 113-124; 2020
[2] Vinogradov, Serguei V. et al Molecular Pharmaceutics, 2(6), 449-461; 2005
目前三甲基硅咪唑制备工艺多采用六甲基二硅氮烷合成法,即在加热回流条件下分两步:一、酯化(浓硫酸)反应,二、硫酸酯与咪唑直接反应合成三甲基硅咪唑。其缺点是:①工艺流程长,需制备原料六甲基二硅氮烷,设备投资大,操作不易控制。②操作环境差,污染重,产生的氨气会造成设备腐蚀。③有副产物硫酸铵生成,导致产物纯度下降。④最后产品冷凝后温度过低时,会造成回流管堵塞,同时物料反应不彻底。
这其中的最大问题是在反应过程中存在副反应,结果使得操作不易控制,工艺流程长,产品收率大幅降低,且纯度下降.

为了改善以上问题,专利 CN102718789A 提出了一种三甲基硅咪唑制备工艺,目的在于:在工艺中添加氯化氢吸收剂,降低体系中氯化氢浓度,反应在较低温度下即可顺利的自行进行,防止抑制反应的发生。步骤如下:
1、反应:首先在搅拌釜内投入三甲基一氯硅烷,然后在搅拌下分批添加咪唑,要求在3小时内添加完成;反应在-200~0mm汞柱下进行,温度控制在60℃以下;反应产生的氯化氢气体经吸收器被吸收剂吸收后通过加压及深冷装置得到≥30%浓盐酸;反应结束后停止搅拌,取样液体分析.
2、精馏:将合格的液体投入精馏塔釜内,在≤92℃塔内采出三甲基一氯硅烷,然后降温采出产品三甲基硅咪唑.
1.本工艺使反应在常温即可进行,且使体系中的氯化氢浓度降低几乎达到0含量,这样避免了反应因氯化氢抑制反应的发生,因而使得①工艺流程变短,投资减少;②反应易于控制,操作费用降低;③收率大幅提高,降低生产成本.
2.本方案按照科学方法配比投料,达到完全反应的效果。蒸馏出剩余物质重复再次使用无废物产生.
4-羟甲基苯硼酸是一种重要的化学中间体,广泛应用于液晶、医药和化工等领域。近年来,随着这些行业的快速发展,对4-羟甲基苯硼酸的需求量也大幅增加。
目前,制备4-羟甲基苯硼酸的主要方法如下:首先,以对溴苄醇为原料,通过一系列反应制备格氏试剂;然后,将制备得到的格氏试剂与硼化试剂进行加成反应;最后,利用酸性离子液体进行水解脱保护,得到目标产品4-羟甲基苯硼酸。这种制备方法能够保证4-羟甲基苯硼酸在水解条件下的稳定性,减少副反应的发生,使得产品总收率可达80%以上,HPLC含量大于99.5%。

图1 4-羟甲基苯硼酸的合成反应式
步骤一、在氮气保护下,将对溴苄醇和咪唑置于烧瓶中,加入三氯甲烷,冰水浴条件下滴加叔丁基二甲基氯硅烷溶液,反应后得到粗品叔丁基二甲基硅氧亚甲基溴苯;
步骤二、将叔丁基二甲基硅氧亚甲基溴苯溶于四氢呋喃中,滴加至含有金属镁的瓶中,反应后得到叔丁基二甲基硅氧亚甲基苯基溴化镁四氢呋喃的反应液;
步骤三、将硼酸三甲酯溶于四氢呋喃中,滴加步骤二中制备的反应液,反应后得到4-羟甲基苯硼酸。
[1]Journal of the American Chemical Society, , vol. 134, # 28 p. 11667 – 11673
N,N'-硫羰基二咪唑是一种重要的医药中间体,被广泛用作酶和蛋白质粘合剂,抗生素类合成药物中间体,特别是作为合成多肽化合物的键合剂。在生化合成中具有非常重要的意义,因为在反应过程中能够保持分子构型不变,不形成氢卤酸。随着生物化学领域的飞速发展,N,N'-硫羰基二咪唑的市场需求量日益增大,可以从硫光气及三甲基硅咪唑为起始物料制备。
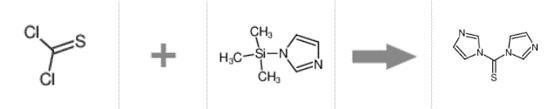
图1 N,N'-硫羰基二咪唑的合成反应式
N,N'-硫羰基二咪唑可用于生化合成反应中基团保护及蛋白质肽链的连接。此外,N,N'-硫羰基二咪唑在有机合成中主要被用作硫羰基转移试剂,与具有活性氢的羟基或者氨基反应生成硫羰基衍生物。因为这些产物中的许多具有重要的生物学活性,或者用作手性衍生物的分离试剂,所以该反应具有相当重要的合成意义。
N,N'-硫羰基二咪唑与羟基化合物反应可以方便地生成硫代甲酸酯化合物,与二羟基底物反应则生成环状硫代碳酸酯的衍生物。由于这些化合物的合成均在中性和非常温和的条件下进行,所以对许多其它官能团不产生明显的影响,具有很宽的应用范围。如果将该反应与金属锡氢化物还原剂连续使用,可以完成羟基的去氧反应。硫代碳酸酯衍生物的去氧反应具有非常高度的选择性,立体位阻效应可能是主要的影响因素之一。如果羟基的邻位有苯基硒取代,则直接生成烯烃化合物。
[1] Selezneva, E. S.; Belousova, Z. P.; Gusak, L. A.; Zvyagina, E. A.; Purygin, P. P. Pharmaceutical Chemistry Journal, 1992 , vol. 26, # 3 p. 259 - 262
瑞德西韦(英语:Remdesivir),又译伦地西韦,商品名韦如意(英语:Veklury),是一种由美国吉利德科学公司开发的实验性广谱抗病毒药物,可用于抑制呼吸道上皮细胞中SARS病毒和MERS病毒的复制,以及针对埃博拉病毒的治疗。它是一种核苷酸类似物前药,能够抑制依赖RNA的RNA合成酶(RdRp)。
根据2020年的研究,瑞德西韦和干扰素IFNB1的联合用药对MERS具有显著疗效。尽管该药物仍在针对埃博拉病毒的临床试验中,但有人猜测它可能是目前对SARS-CoV-2冠状病毒最理想的药物。然而,世卫组织支持的研究结果表明该药物对该病毒的疗效有限。2020年10月22日,FDA批准瑞德西韦成为第一个治疗2019冠状病毒病的药物。
瑞德西韦可以通过多步合成从核糖衍生物中得到。下图展示了吉利德科学公司的Chun等人发明的瑞德西韦合成方法之一。
该方法首先使用丙胺酸酯盐酸盐和二氯氧磷苯酚酯在三乙胺和二氯甲烷中制备中间体a。然后,将三苄基保护的核糖在乙酸酐和二甲基亚砜中氧化成内酯中间体b。接下来,吡咯并[2,1-f]三嗪-4-胺经过溴代和三甲基氯化硅保护后,使用正丁基锂在-78°C下进行锂卤交换反应得到中间体c。
然后,将中间体b缓慢加入含有中间体c的溶液中进行反应。在弱酸性水溶液中淬灭反应后,得到1:1的变旋异构物。接着,在二氯甲烷和-78°C条件下,与过量的三甲基氰硅烷反应10分钟。随后,加入三氟甲磺酸三甲基硅脂反应1小时,并在碳酸氢钠水溶液中淬灭,得到腈基化中间体。
接下来,在二氯甲烷和-20°C条件下,与三氯化硼反应以去除苄基保护基。在碳酸钾和甲醇的混合物中淬灭过量的三氯化硼,得到去除苄基的中间体。然后,通过反相HPLC分离变旋异构物。最后,将光学纯的化合物与中间体a在磷酸三甲酯和甲基咪唑的作用下反应,得到瑞德西韦的非对映异构体混合物。
