乙烯基氯化镁,又称Vinylmagnesium chloride,是一种常用的有机格式试剂,具有极高的化学反应活性。它主要存在于溶液中,在醚类溶剂中稳定性较好,常用于有机合成基础化学试剂。乙烯基氯化镁在化学领域中被广泛应用,可用于引入乙烯基单元到目标有机分子结构中,同时在基础化学研究和医药生产领域也有重要应用。
乙烯基氯化镁具有极强的亲核性,可与常见的亲电试剂如醛酮类化合物发生亲核加成反应,用于制备烯丙醇类衍生物。此外,乙烯基氯化镁还可在金属钯催化下与芳基卤化物发生交叉偶联反应,用于制备苯乙烯类衍生物。
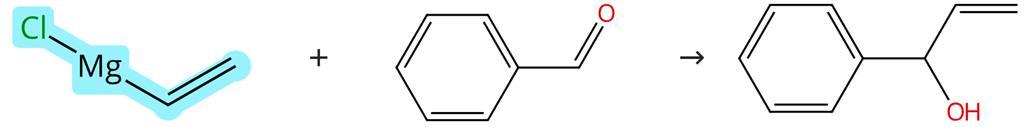
图1 乙烯基氯化镁的亲核加成反应
在干燥的条件下,将苯甲醛溶于四氢呋喃中,然后将乙烯基氯化镁缓慢加入混合物中,控制温度在0℃。反应结束后,用盐酸水溶液淬灭反应,通过萃取、洗涤、干燥和层析纯化得到目标产物。
乙烯基氯化镁通常以溶液形式存在于无水乙醚或四氢呋喃等醚类溶剂中。为了保持其稳定性和反应性,储存时需在惰性气氛下操作,避免与空气中的水气和氧气发生反应。
[1] Atack, Thomas C. ; et al ACS Medicinal Chemistry Letters,2020,11,2131-2138.
吲哚又称苯并吡咯,是吡咯与苯并联的化合物,吲哚最早是由靛蓝降解而得。吲哚及其同系物和衍生物广泛存在于自然界,如天然花油、茉莉花、水仙花等中。吲哚的衍生物种类十分繁多,如色氨酸、生物碱、植物生长素等。7-氟吲哚是一种吲哚衍生物。英文名为7-Fluoroindoline-2-one,分子量135.14,是化学试剂、精细化学品、医药中间体、材料中间体。该物质对环境可能有危害,对水体应给予特别注意。
目前报道的制备7-氟吲哚的方法主要有:1)Bartoli吲哚合成法,2-卤代硝基苯与三倍量乙烯基格式试剂在-78 ℃直接反应制备7-氟吲哚,该法反应温度极低,条件苛刻;2)Leimgruber-Batcho吲哚合成法,以3-卤代邻硝基甲苯与 DMF-DMA 经缩合、还原及分子内关环反应制备7-卤代吲哚,但原料3-卤代邻硝基甲苯相对较贵;3)吲哚为原料制备法,吲哚与甲酸及1-(3-二甲基氨基丙基)-3-乙基碳二亚胺经酰基化、铊化、卤代、碱水解、脱氢反应后制备得7-氟吲哚,但铊化合物剧毒,且反应步骤过于繁琐,收率低;
有研究以邻卤代苯胺和水合氯醛、盐酸羟胺为原料,通过Sandmeyer异亚硝基乙酰替苯胺合成法制备得7-卤代靛红,再经硼氢化钠/三氟化硼乙醚体系还原制备得7-氟吲哚,合成路线如图。

工业生产步骤如下:在邻氟硝基苯原料罐中加入邻氟硝基苯的有机溶剂溶液,将乙烯基氯化镁原料罐中加入乙烯基氯化镁的有机溶剂溶液,有机溶剂可以为四氢呋喃等。将邻氟硝基苯溶液和乙烯基氯化镁溶液按照一定的流速泵入微通道反应器中,保持邻氟硝基苯与乙烯基氯化镁的当量之比为1:3.0-4.0,微通道反应器的温度为-45℃~-20℃,物料的保留时间为3s-5s。物料进入釜式反应器,釜式反应器的温度为-45℃~-20℃,同时像釜式反应器内通氮气,通过物料的流速以及釜压的控制,保持物料在釜式反应器内的保留时间为20min-35min。物料从釜式反应器中持续流出,在三通管处与第三输液泵泵出的饱和氯化铵溶液接触,物料与饱和氯化铵溶液瞬间混合后淬灭,达到及时停止反应的效果,然后物料继续流入接料釜中。接料釜中的物料再经过分液、有机相用乙酸乙酯萃取、盐洗、干燥、柱层析纯化后得黄色固体粉末,即为7-氟吲哚产品。所得7-氟吲哚的收率能达到65%左右。
[1]刘长春,程进,蒋若愚,刘承先,李雪莲,薛叙明.7-卤代吲哚的合成工艺研究[J].精细石油化工,2018,35(03):39-45.
苯丙炔酸是一种丙炔酸类化合物,广泛应用于有机合成和功能材料制备。此外,丙炔酸还可用于合成香豆素、黄酮和吲哚等杂环化合物,以及合成炔基芳烃或氨基炔烃的脱羧基交叉耦合反应。

一种利用微反应器连续快速制备苯丙炔酸及其衍生物的方法如下:
首先,在无水无氧条件下,将金属镁、碘单质和无水乙醚加入反应器中,搅拌均匀。然后缓慢滴加氯乙烯,滴加速度要维持液体沸腾状态。滴加结束后,加热至100℃回流120分钟,得到乙烯基氯化镁和乙醚混合溶液。
接下来,将含有乙烯基氯化镁的乙醚溶液和苯乙炔分别注入微混合器中混合后,进入微通道反应器中,在40℃条件下反应10秒,发生格氏交换反应得到苯乙炔基氯化镁。然后,将CO2按照苯乙炔基氯化镁与CO2摩尔比1:0.8注入微混合器中与合成的苯乙炔基氯化镁混合后,进入微通道反应器中,在40℃条件下反应10秒进行亲核加成反应。反应后,收集样品并经水解得到苯丙炔酸。
在反应瓶中加入苯乙炔和超干的四氢呋喃,进行真空处理和N2保护。然后将反应瓶放入-78℃的乙醇溶液中,加入正丁基锂,反应一段时间后,接入二氧化碳气球,继续反应。最后,加入饱和的氯化铵溶液,搅拌一段时间。反应结束后,用乙醚和乙酸乙酯进行萃取和干燥,得到苯丙炔酸产物。
[1] [中国发明] CN202010489397.0 一种利用微反应器连续快速制备丙炔酸及其衍生物的方法
[2] [中国发明] CN201911379903.4 含恶唑及三唑双杂环的化合物及其制备与应用方法

目前已知的乙烯基三氟硼酸钾的合成方法,基本是采用乙烯基格氏试剂与硼酸三钾酯在-70℃反应,反应结束加酸淬灭后直接加氟氢化钾氟化,再将反应液蒸干加丙酮溶解滤出盐,母液蒸馏后加乙醚打浆过滤得到产品。此方法有一些缺陷:此工艺需要超低温反应,且氟化反应结束后很难实验工业化生产,而且产品提纯用到乙醚易燃,蒸汽与空气混合易爆炸,采购,运输,存储及使用存在很多安全隐患。
一种制备乙烯基三氟硼酸钾的方法,乙烯基氯化镁、甲氧基硼酸频哪醇酯为例:
第一步原料乙烯基硼酸频哪醇酯的制备:
向一个装有磁力搅拌、温度计、冷凝管的500ml的四口瓶内加入28.76g(0.182 mol)甲氧基硼酸频哪醇酯,96.9ml四氢呋喃,控制釜温滴加100g(2mol/kg、0.2mol)乙烯基氯化镁四氢呋喃溶液,滴加结束气相监测反应结束,控制室温滴加10%的盐酸调PH值6~7,分出有机层211.93g,含乙烯基硼酸频哪醇酯10.9%,收率75%。
第二步乙烯基三氟硼酸钾的制备:
向一个装有磁力搅拌、温度计、冷凝管的500 mL四口瓶内加入10.9%的乙烯基硼酸频哪醇酯溶液211.93g(0.15mol),氟氢化钾29.29g(0.375mol),DMF 46ml,控温80~100℃搅拌6~8小时,TLC监测反应结束,蒸出溶剂后,加140ml丙酮溶解过滤,母液减压蒸馏后,加110ml甲基叔丁基醚打浆,过滤出湿饼真空干燥,得到13.67g产品,收率68%,纯度96%。
本发明的创新性在于对于避免了文献超低温-70℃反应,而是控制室温将乙烯基格氏试剂滴入1-取代基硼酸频哪醇酯中进行硼酯化反应,然后淬灭分出含乙烯基硼酸频哪醇酯的有机层,可直接进行下一步氟化,经甲基叔丁基醚提纯制备乙烯基三氟硼酸钾的方法,此方法原料易得、操作简便、反应条件温和,安全环保、成本低、收率高。
CN103044472A
格林雅试剂是一种活泼的有机试剂,以其发现者V.A.Grginard命名。它可以与水、二氧化碳、醇、醛、酮、酯、胺和环氧化合物等发生反应,生成各种类型的有机化合物。格林雅试剂在有机合成化学中扮演着重要的角色,并广泛应用于元素有机化合物的合成中。其中,4-甲氧基苯乙烯基氯化镁是格林雅试剂的一种。

4-甲氧基苯乙烯基氯化镁可用于制备N-[(3R)-1-氮杂二环[2.2.2]辛-3-基]-2-呋喃-2-基-2-羟基-4-(4-甲氧基苯基)丁酰胺。制备方法如下:将2g(0.014mol)的2-呋喃-2-基-2-氧代乙酸和两滴DMF加入40mlCHCl3(不含乙醇)中,冷却至0°C形成悬浮液,然后加入1.17ml(0.013mol)的草酰氯。将混合物升温至室温并搅拌1小时,然后真空浓缩至干燥,将残余物溶于CHCl3(20ml)后再次浓缩。重复该步骤两次。将所得产物溶于CHCl3(50ml),冷却至0°C,然后加入1.7g(0.013mol)的(3R)-氨基奎宁环。将混合物升温至室温并持续搅拌16小时。然后用饱和的K2CO3处理反应混合物,用CH2Cl2萃取水层,合并有机层,用水洗涤,Na2SO4干燥,过滤后蒸发。所得产物(N-[(3R)-1-氮杂二环[2.2.2]辛-3-基]-2-(2-呋喃基)-2-氧代乙酰胺)无需进一步提纯即可用于下一步反应。
将所得产物溶于无水THF(50ml),冷却至-80°C后,加入0.021mol(43ml0.5M的THF溶液)的4-甲氧基苯乙烯基氯化镁作为格利雅试剂。将混合物升温至室温并反应3小时。然后,用饱和的NH4Cl处理反应混合物,再用AcOEt和CH2Cl2萃取。合并有机层,Na2SO4干燥,过滤后蒸发溶剂。所得产物经过柱色谱法(硅胶,CHCl3∶MeOH∶NH4OH99∶1∶1→CHCl3∶MeOH∶NH4OH97∶3∶1作洗脱剂)提纯,可以得到2.4g的标题化合物(44%的起始原料酸),它是非对映异构体的混合物。
[3]有机化学手册
[4]CN03820648.X奎宁环酰胺衍生物
(S)-(+)-1-[(R)-2-(二苯基膦)二茂铁]乙基二环已基膦是一种Josiphos类手性二茂铁膦配体,具有广泛的应用前景。它在烯烃不对称氢胺化、Michael加成等不对称有机合成反应中发挥着重要作用,并在工业生产中得到广泛应用,尤其在药物和精细化学品的合成中。

在氩气保护下,将二茂铁、三氯化铝和正己烷加入干燥反应器中,然后在-20℃滴加二环己基氯化膦。反应完成后,加入水淬灭,分液并用无水硫酸镁干燥有机层。经过减压蒸馏除去溶剂后得到黄色固体,再用甲醇重结晶得到1-(二环己基膦基)二茂铁。
在氩气保护下,将二苯基氯化膦和四氢呋喃加入干燥反应器中,然后在0℃滴加乙烯基氯化镁的四氢呋喃溶液。反应完成后,加入水淬灭,分液并用无水硫酸镁干燥有机层。经过减压蒸馏除去溶剂后得到白色固体,再用二氯甲烷和甲醇重结晶得到乙烯基二苯基膦。
在氩气保护下,将1-(二环己基膦基)二茂铁、乙烯基二苯基膦、三氯化铁、D-脯氨酸和二氯甲烷加入干燥反应器中,然后在25℃反应。反应完成后,加入水淬灭,分液并用无水硫酸镁干燥有机层。经过减压蒸馏除去溶剂后得到黄色固体,再用二氯甲烷和甲醇重结晶得到(S)-(+)-1-[(R)-2-(二苯基膦)二茂铁]乙基二环已基膦。
[1] Hans-Ulrich Blaser, Matthias Lotz, Andrey Yu. Platonov. R)‐1‐[(1R)‐1‐(Dicyclohexylphosphino) ethyl]‐2‐(diphenylphosphino)‐ferrocene and (2S)‐1‐[(1R)‐1‐(Dicyclohexylphosphino) ethyl]‐2‐(diphenylphosphino)‐ferrocene (Josiphos)[M]// e-EROS Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, 2014.
[2] [中国发明,中国发明授权] CN201610356032.4 Josiphos类手性二茂铁膦配体的合成方法
4-乙烯基苯甲酸是重要的有机合成中间体,在医药中间体和感光材料的合成中有着广泛的用途,本文简述其制备工艺。
本文以对溴苯甲酸为原料,在溶剂四氢呋喃中,与格氏试剂异丙基氯化镁交换得到溴化镁对苯甲酸格氏试剂,然后把乙醛滴加到合成的格氏试剂中,反应完后,酸化后处理得到中间产品对羟乙基苯甲酸,再在DMSO中,用浓硫酸脱水得到4-乙烯基苯甲酸。其合成反应式如下图所示[1]:

图1 4-乙烯基苯甲酸的合成反应式
异丙基格氏试剂的制备
在氮气保护下,往250 mL三口烧瓶加5.5 g镁屑(0.23mol),5 g无水四氢呋喃,加0.1 g碘作为引发剂,先滴加少量异丙基氯的四氢呋喃溶液,格氏试剂引发后,保持40~60 ℃,缓慢滴加11.8 g异丙基氯(0.15mol)和36 mL四氢呋喃的溶液。滴加完后,40~50℃反应3 h。
对羟乙基苯甲酸的合成
将对溴苯甲酸8 g(0.04 mol)溶于96 mL无水四氢呋喃内,在℃以下滴加格氏试剂内。滴毕,控制温度在0-10℃下反应。反应到原料含量降到1.3%。再把温度降到0-10℃,滴加9.3 g乙醛(0.21 mol),滴加完后,再升温到0-10℃反应2.5 h,0-10℃滴加稀盐酸,调pH=2,用2x50 mL乙酸乙酯萃取,50 mL饱和盐水洗一次。无水硫酸钠干燥。过滤,45℃真空脱溶剂。脱干后得黄色粘稠状液体。加10 mL乙酸乙酯溶解,搅拌5 min,滴加68 mL石油醚。滴毕在室温(0-10℃),搅拌1 h。过滤,得对羟乙基苯甲酸中间产品4.7 g。产率71.0%,含量95.8%。
4-乙烯基苯甲酸的合成
往反应瓶中加0.63 g对羟乙基苯甲酸,DMSO约10 g,浓硫酸1.1 g,升温到120-138℃反应2.4 h,冷却到窒温,加10 mL水。用2x20 mL二氯乙烷萃取。有机相加30%NaOH溶液30 mL中和,分层,水相用2x20 mL TBME萃取杂质,水相用1:1盐酸酸化,再用2x25 mL乙酸乙酯萃取产品。用15 mL水洗有机相3次,在50℃水浴,用真空脱去溶剂,得到1.2 g粗产品,粗产品用10 mL甲醇溶解。滴加50 mL水重结晶,过滤,烘干得到0.37 g4-乙烯基苯甲酸。收率65.5%,含量99.4%。
[1]Hou, Zhaomin Angewandte Chemie - International Edition, 2008 , vol. 47, # 31 p. 5792 - 5795

2,6-二叔丁基吡啶是一种有机化合物,化学式为tBu2C5H3N,其中tBu为叔丁基。2,6-二叔丁基吡啶是无色的油状液体,是具有位阻的有机碱。例如,它可以质子化,但不能和三氟化硼形成加合物。2,6-二叔丁基吡啶可由叔丁基锂和吡啶的反应制得。在钯催化下,2,6-二叔丁基吡啶可以和氢气反应,得到2,6-二叔丁基哌啶。该试剂可能有毒,小心处理,应在通风橱中进行操作。
1、在气相中,2,6-二叔丁基吡啶有很强的碱性,但在溶液中则为弱碱性,是由于溶剂化空间阻碍所致。因此,2,6-二叔丁基吡啶与HCl形成盐酸盐,但与MeI或BF3则不反应[1]。
2、在[反-2,3-反-5,6-d4]-1,4-二氧杂环己烷和二乙烯基酮的合成中,2,6-二叔丁基吡啶碱用来抑制酸催化的侧链反应或亲核反应 (式1,式2)。
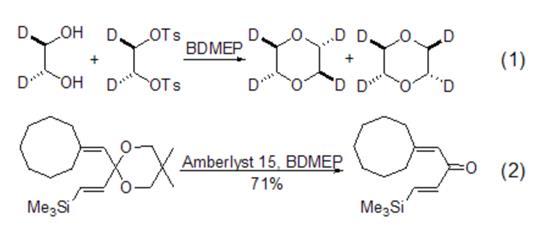
图1 2,6-二叔丁基吡啶催化亲核反应示意图
3、2,6-二叔丁基吡啶及其类似物 (如4-甲基-2,6-二叔丁基吡啶)可用于羰基化合物或三氟甲磺酐制备乙烯基三氟甲磺酯的反应。因为与聚合物结合的2,6-二叔丁基吡啶可以重复使用,从而能得到很好的实验结果。由2,3-二氢-4H-吡喃-4-酮衍生物制得的中间体乙烯基硅烷可与炔烃发生Diels-Alder反应得到甲硅烷基苯基醚。在2,6-二叔丁基吡啶作用下,缩合的甲醛与三甲基甲硅烷基酮醚反应生成β-烷氧基酮。
4、在2,6-二叔丁基吡啶存在条件下,烯丙基醇的衍生物在甲醇中与PhSeBr反应,发生硒和甲氧基的加成反应,该反应具有很高的区域选择性和立体选择性。
采用价廉易得的卤代吡啶为原料,采用叔丁基氯化镁,卤化锌及氰化亚铜联合使用的反应体系,将叔丁基引入吡啶环,简化了反应步骤,且反应收率较高。
[1] 2. Nakamura, E.; Kubota, K.; Isaka, M. J. Org.Chem., 1992, 57, 5809.