苯基二甲基氯硅烷是一种常用的有机合成试剂,具有广泛的应用领域。它可以作为羟基保护基团,用于保护羟基。与其他硅保护基一样,它的硅单元容易在碱性或含氟负离子的体系中脱除。此外,它的苯环结构可以在氢气的还原作用下转化为环己基结构,而硅上的氯原子不会被氢解。

图1 展示了苯基二甲基氯硅烷的合成路线。在0℃下,将二氯二甲基硅烷与溴化苯基镁反应,反应混合物经过旋蒸和真空蒸馏提纯,最终得到氯(苯基)二甲基硅烷。
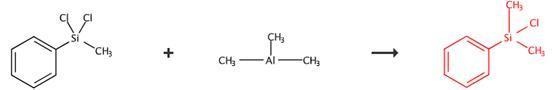
图2 展示了另一种合成苯基二甲基氯硅烷的方法。通过将Ni (cod)2和PCy3与1, 4-二氧六环反应,然后加入二氯硅烷和三烷基铝,在60℃下反应24小时,最后通过蒸馏提纯得到产物。
苯基二甲基氯硅烷作为羟基保护基团,广泛应用于有机合成中。它的应用领域包括药物合成、材料科学等。由于其特殊的化学性质,它在保护羟基的同时不会被氢解,具有较高的选择性和效率。
[1] Simarek, Adam et al Applied Organometallic Chemistry, 32(8), 2018.
[2] Naganawa, Yuki et al ChemCatChem, 11(16), 3756-3759; 2019.
叔丁基二甲基氯硅烷是一种白色透明结晶体,其英文名称为Tert-butyl dimethly chlorosilane。它的沸点为124°C -126°C,熔点为87℃ -90℃。

以前常用的合成方法是将叔丁基氯和镁制成格氏试剂(叔丁基氯化镁),然后与二甲基二氯硅烷反应。
由于格氏试剂对水分非常敏感,因此在反应过程中需要保持原料和装置的干燥。通常还需要通入干燥的惰性气体进行保护,以防止湿气进入反应系统,确保反应的安全和顺利进行。
CN101817842A公开了一种制备叔丁基二甲基氯硅烷的方法,其特点如下:
a、在合成釜内,将10-15重量份的镁投入到由乙醚和环己烷组成的混合溶剂中(体积份为160-240),在40℃-55℃的条件下,滴加由35-55重量份的叔丁基氯和50-78重量份的二甲基二氯硅烷组成的混合溶液。滴加完毕后,保温2.5-3.5小时,得到合成后的物料。
b、将合成后的物料转入溶解釜,降温至10℃-15℃,然后滴加400-600体积份的体积浓度为25~30%的盐酸,静止分层,除去底部的废水,得到上层料液。
c、将溶解釜内的上层料液转移到精馏釜中进行提纯,去除溶剂,得到叔丁基二甲基氯硅烷产品。

这种合成方法具有操作简单、易控制、安全性高、产品收率稳定的优点。它避免了分离固体镁盐的复杂程序,生产环境清洁,无污染。以二甲基二氯硅烷为基准,叔丁基二甲基氯硅烷的收率可达82%,产品纯度达到99.0%。
叔丁基二甲基氯硅烷(TBDMSCl,TBSCl)是一种重要的有机硅保护剂,可以取代有机化合物中的活泼氢,生成化学稳定性很高的中间产物,而不影响其他基团的反应活性。与常见的三甲基氯硅烷保护剂相比,TBDMSCl硅醚的稳定性更高,具有优异的选择性,可以在仲醇或叔醇存在下对伯醇进行选择性保护。因此,TBDMSCl被广泛应用于药物和天然产物的合成中,例如合成前列腺素、甾素化合物、某些抗生素以及降血脂药洛弗斯汀和新弗斯汀的辅助原料等。
以下是一种制备叔丁基二甲基氯硅烷的方法:
a、在合成釜内,将10g的镁投入到160ml的乙醚和环己烷组成的混合溶剂中,混合溶剂中乙醚和环己烷的体积比为6.5∶3.5,在40℃条件下,滴加由35g叔丁基氯与50g二甲基二氯硅烷组成的混合溶液,滴完后保温2.5小时,得合成后物料;
b、将合成后物料转入溶解釜,降温至10℃后滴加400ml的体积浓度为25%盐酸,静止分层,除去底部的废水,得上层料液;
c、将溶解釜内上层料液转至精馏釜提纯,去除溶剂,得产品叔丁基二甲基氯硅烷。
以下是一种叔丁基二甲基氯硅烷工业化生产结晶制备方法:
步骤1:取料:取48kg叔丁基二甲基氯硅烷溶液放入80L容器内;
步骤2:蒸馏结晶:将步骤1的容器加热50℃以上,进行蒸馏,在蒸馏的过程中进行搅拌,直到结晶完成;
步骤3:冷却:将步骤2得到的晶体自然放置冷却;
步骤4:挤压:将步骤3冷却后的晶体放入挤压机内进行挤压,反复挤压20次;
步骤5:振荡:将步骤4挤压20次后的晶体振荡均匀;
步骤6:再挤压:将步骤5振荡后的晶体再进行挤压,反复挤压20次;
步骤7:过筛:将步骤6得到的晶体用网孔不大于10毫米的过聚四氟网进行筛选,从而得到颗粒大小均匀的白色晶体;
步骤8:重复挤压:将步骤7筛上物重复挤压直到可以通过网孔不大于10毫米的过聚四氟网;
步骤9:包装:将步骤7和步骤8得到的筛下物进行定量包装。
[1][中国发明]CN201010150508.1一种叔丁基二甲基氯硅烷的制备方法
[2][中国发明]CN201410732762.0一种叔丁基二甲基氯硅烷工业化生产结晶制备方法
叔丁基二甲基氯硅烷,英文名称:Tert-butyl dimethly chlorosilane,分子式为:t-C4H9(CH3)2SiCl,外观性状为:白色透明结晶体,沸点:124℃-126℃,熔点:87℃-90℃。
目前采用较多的为:以叔丁基氯和镁制成格氏试剂(叔丁基氯化镁)再与二甲基二氯硅烷反应。
由于格式试剂对水分十分敏感,故所用原料及装置流程必须保持干燥,在反应过程中,通常还要通入干燥惰性气体进行保护,防止湿气进入反应系统,以确保反应安全顺利的进行。
金属镁多以镁屑或镁粒状态投用,表面易氧化吸潮,所以顺利启动是反应的关键。金属镁的反应活性严重影响启动反应的稳定性。有时需要提高反应温度,有时则在升温中突然剧烈反应,严重时甚至引起冲料或爆炸。
目前采用的格氏法生产中:彻底除去镁盐是提高叔丁基二甲基氯硅烷质量的关键。但不是很容易。通常采用密闭式离心机或压滤器除去镁盐残渣。但是,细粒子镁盐很容易穿过滤袋而进入滤液中,加热精馏时,易引起氯硅烷的分解与歧化。滤饼中脱液不完全,溶剂损耗严重,同时也带走了部分溶于溶剂中的产品。
本发明的目的是提供一种合成工艺简单,安全性高,产品收率稳定的叔丁基二甲基氯硅烷的制备方法。
一种叔丁基二甲基氯硅烷的制备方法,
a、在合成釜内,将10-15重量份的镁投入到160-240体积份由乙醚和环己烷组成的混合溶剂中,在40℃-55℃条件下,滴加由重量份为35-55叔丁基氯与重量份为50-78的二甲基二氯硅烷组成的混合溶液,滴完后保温2.5-3.5小时,得合成后物料;
b、将合成后物料转入溶解釜,降温至10℃-15℃后滴加400-600体积份的体积浓度为25~30%盐酸,静止分层,除去底部的废水,得上层料液;
c、将溶解釜内上层料液转至精馏釜提纯,去除溶剂,得产品叔丁基二甲基氯硅烷。
所述混合溶剂中乙醚和环己烷的体积比为(6.5-7.5)∶(3.5-2.5)。
所述废水为氯化镁水溶液。
其化学反应式如下:
(CH3)3CCl+Mg——(CH3)3CMgCl
(CH3)3CMgCl+(CH3)2SiCl2——t-C4H9(CH3)2SiCl+Mg Cl2
本发明的优点:合成工艺的生产操作简单,易控制,安全性高,产品收率稳定,避免了分离固体镁盐的复杂程序,生产环境清洁,无污染。以二甲基二氯硅烷为基准,产品叔丁基二甲基氯硅烷的收率达82%,产品纯度99.0%。
图1是本发明工艺流程方框示意图。

如图1所示,一种叔丁基二甲基氯硅烷的制备方法,
a、在合成釜内,将10g的镁投入到160ml的乙醚和环己烷组成的混合溶剂中,混合溶剂中乙醚和环己烷的体积比为6.5∶3.5,在40℃℃条件下,滴加由35g叔丁基氯与50g二甲基二氯硅烷组成的混合溶液,滴完后保温2.5小时,得合成后物料;
b、将合成后物料转入溶解釜,降温至10℃后滴加400ml的体积浓度为25%盐酸,静止分层,除去底部的废水,得上层料液;
c、将溶解釜内上层料液转至精馏釜提纯,去除溶剂,得产品叔丁基二甲基氯硅烷。
来源:CN101817842
11-溴代正十一烷基二甲基氯硅烷是一种有机中间体,可用于制备动态聚合物。动态聚合物是一类由动态化学键链接形成的新型聚合物体系。根据动态化学键的不同,动态聚合物可以分为基于超分子相互作用的物理型动态聚合物和基于动态共价键的共价型动态聚合物。共价型动态聚合物由动态可逆共价键构造,具有特殊性质和优良的机械性能。此外,共价型动态聚合物还具有刺激响应性、自修复性、可回收性和可再加工性等特性。

根据CN201610382046.3的报道,11-溴代正十一烷基二甲基氯硅烷可用于制备具有动态交联结构的动态聚合物。

制备过程中,首先在干燥洁净的三口烧瓶中加入40ml四氢呋喃溶剂,并通过氩气鼓泡除氧。然后加入环状有机硼酸硅酯化合物(a)、乙酸水溶液、1,8-辛二硫醇(b)、光催化剂DMPA和三乙胺。反应完成后,将反应液倒入模具中,在50℃真空烘箱中进行进一步的反应和除溶剂。最终得到粘性的聚合物胶体,具有较低的表面强度和硬度,但可进行大范围的拉伸而不断裂(断裂伸长率可达1500%)。该聚合物可作为超级热熔胶或室温自粘性材料使用,并可通过加热修复表面缺陷,同时可通过有机硼酸硅酯键的解离进行回收。
[1][中国发明,中国发明授权]CN201610382046.3一种具有动态交联结构的动态聚合物
叔丁基二甲基氯硅烷(TBDMSCl)是一种在有机合成中广泛应用的重要保护基。它可以与羟基、酮、酯或酰胺反应生成相应的硅醚或烯醇硅醚。与其他保护基相比,TBDMSCl具有更高的化学稳定性和较高的产率。该试剂在无水体系中使用,并建议在通风橱中操作和使用。
TBDMSCl与羟基反应通常在CH2Cl2、THF或DMF中进行,咪唑、吡啶和Et3N可用作碱。DMAP常用作催化剂,但在使用Et3N作为碱时,DMAP催化剂是必需的。该反应在多羟基底物上的选择性与溶剂和碱催化剂的选择有关,CH2Cl2-Et3N-DMAP组合具有最佳的选择性。
TBDMSCl与酚羟基的反应与醇羟基类似,但反应的温度较高。无论是醇羟基还是酚羟基生成的硅醚,去保护基的条件基本相同。通常在aq. HCl-丙酮、HF-吡啶或n-Bu4NF-THF体系中室温下搅拌数分钟即可高产率地完成去保护反应。
TBDMSCl还可以与羰基发生烯醇化反应生成烯醇硅醚。在强碱的存在下,TBDMSCl与酮羰基反应可以高产率地得到TBDMS硅醚。常用的碱包括LDA、KHMDS和碱金属氢化物。
TBDMSCl与酸酸酯和羧酸酰胺反应需要在强碱的作用下进行,并且加入HMPA或DMPU有利于提高反应的速度和产率。
通过以上的反应,TBDMSCl可以在有机合成中起到重要的保护基的作用。




1. Chun, J.; Yin, Y. I.; Yang, G.; Tarassishin, L.; Li, Y.-M. J.Org. Chem., 2004, 69, 7344.
2. Mehta, G.; Pan, S. C. Org. Lett., 2004, 6, 3985.
3. Chen, G.; Schmieg, J.; Tsuji, M.; Franck, R. W. Org. Lett.,2004, 6, 4077.
4. Ochiai, H.; Ohmae, M.; Kobayashi, S. Carbohydr. Res., 2004,339, 2769.
5. Ngo, H. L.; Lin, W. J. Org. Chem., 2005, 70, 1177.
6. Kenmoku, S.; Urano, Y.; Kanda, K.; Kojima, H.; Kikuchi, K.;Nagano, T. Tetrahedron, 2004, 60, 11067.
7. Chodounska, H.; Pouzar, V.; Budesinsky, M.; Slavikova, B.;Kohout, L. Steroids, 2004, 69, 605.
8. Molander, G. A.; St. Jean, D. J., Jr.; Haas, J. J. Am. Chem.Soc., 2004, 126, 1642.
9. Dalgard, J. E.; Rychnovsky, S. D. J. Am. Chem. Soc., 2004,126, 15662.
10. Neuschuetz, K.; Simone, J.-M.; Thyrann, T.; Neier, R. Helv. Chim. Acta, 2000, 83, 2712.