伊潘利酮是一种常用的制药化合物,具有广泛的应用领域。那么,伊潘利酮是由哪些成分配置而成的呢?让我们来了解一下伊潘利酮的成分组成。
伊潘利酮的化学名称为2-(4-异丙基苯基)乙酮,它是一种酮类化合物。伊潘利酮的分子式为C13H18O,分子量为190.29。它是通过特定的合成方法合成而成,具有一定的结构和性质特点。
除了主要的化学结构外,伊潘利酮还可能包含一些辅助成分或配方中的其他成分。这些成分可能是用于改善伊潘利酮的稳定性、增强药效或改变其药物释放特性的物质。具体的成分配置可能因制药公司和产品而有所不同。
然而,需要注意的是,伊潘利酮作为一种药物,其成分配置属于专利保护范围,因此详细的成分信息可能受到商业机密的保护。这意味着具体的成分配置可能不会公开或广泛提供。
总结起来,伊潘利酮是一种由特定的化学合成方法合成而成的酮类化合物。除了主要的化学结构外,伊潘利酮可能包含一些辅助成分或配方中的其他物质。通过了解伊潘利酮的成分组成,我们可以更好地理解和应用这种重要的制药化合物。
盐酸伊托必利和多潘立酮都是用于治疗胃肠道动力不足的药物,多潘立酮是常用的治疗胃动力不足引起消化不良的药物。而盐酸伊托必利则是一种新一代的胃肠道促动力药物,对功能性消化不良的治疗效果更好。

盐酸伊托必利和多潘立酮的作用机理不同。多潘立酮是一种强效的多巴胺受体拮抗剂,而盐酸伊托必利则通过阻断多巴胺D2受体和抑制乙酰胆碱酯酶活性来发挥作用。在疗效和不良反应方面,盐酸伊托必利优于多潘立酮,并且可以与其他药物联合治疗功能性消化不良。

盐酸伊托必利在促进肠动力方面比多潘立酮更优秀!
肠动力不足和胃动力不足有不同的表现。胃动力不足主要表现为胃胀和反酸等症状,而肠动力不足则主要表现为排便不规律和下腹胀气。
长期肠动力不足可能导致多种疾病,如结肠无力、长期腹胀、无便意和大便间隔时间长等,这会增加患结肠癌的风险。
此外,肠道是人体最大的吸收营养和排毒的器官,肠动力异常不仅会影响营养吸收,还会导致毒素无法排出,从而出现营养不良和肝功能受损等问题。
判断肠动力不足的标准包括:
背景及概述[1]
前胃肠动力障碍是功能性消化不良的主要原因,因此促胃肠动力药是治疗FD的主要药物。常用的促胃肠动力药包括甲氧氯普胺、多潘立酮、伊托必利、左舒必利、莫沙必利、西沙必利和阿考替胺等。阿考替胺是一种新型的FD治疗药物,其中2,4,5-三甲氧基苯甲酸是其重要的医药合成中间体。传统的合成方法使用重金属盐或过酸作为氧化剂,但存在反应条件剧烈、氧化剂价格昂贵、后处理复杂、产物纯化困难和环境污染等问题。因此,需要寻找一种更理想的制备方法。
制备[1]
一种制备细辛醛的方法包括以下步骤:
步骤1:向反应瓶中加入1,2,4-三甲氧基苯和DMF,控制温度并滴加含三氯氧磷的DMF溶液,加热搅拌。
步骤2:通过TLC检测反应完全后,将反应液倾入冷水中,调节pH值并析晶。
应用[1]
细辛醛可用于制备2,4,5-三甲氧基苯甲酸。
1)向反应瓶中加入细辛醛、ZrO2/MCM-41纳米催化剂、硝酸银和乙腈,滴加过氧化氢溶液并加热反应。
2)反应完毕后,进行酸碱调节、萃取、洗涤和干燥等步骤,最终得到2,4,5-三甲氧基苯甲酸。
ZrO2/MCM-41纳米催化剂的制备方法如下:
步骤1:将MCM-41沸石粉末活化后与乙醇混合,经过球磨后加入氨水和TEOS,得到改性的MCM-41滤饼。
步骤2:将ZrO2与碱溶液混合得到悬浮液,然后与含有硝酸镍和硝酸铝的盐溶液混合。
步骤3:将改性的MCM-41滤饼与悬浮液反应后进行过滤、洗涤和干燥,最终得到ZrO2/MCM-41纳米催化剂。
[1] CN201810279852.7一种医药中间体2,4,5-三甲氧基苯甲酸的合成方法
6-氟-3-哌啶-4-基-1,2-苯并异唑盐酸盐是制备帕利哌酮、伊潘立酮等药物的重要中间体,它的CAS号为84163-13-3。
为了制备这种中间体,我们可以采取以下步骤:首先将(2,4-二氟苯基)-4-哌啶基甲酮盐酸盐、碱、盐酸羟胺、醇和水混合,然后加热反应。所用的醇可以是正丁醇、伯丁醇、叔丁醇和戊醇中的一种或多种。接下来,在反应液中加入碱,保温进行环合反应,然后过滤,分离有机相。在有机相中加入盐酸,使其反应成盐,即可得到6-氟-3-哌啶-4-基-1,2-苯并异唑盐酸盐。

图1 展示了6-氟-3-哌啶-4-基-1,2-苯并异唑盐酸盐的合成反应式。
这种制备方法采用一锅法合成6-氟-3-哌啶-4-基-1,2-苯并异唑,无需控制水分含量小于0.5%,减少了所需试剂的种类,简化了工艺流程,同时降低了三废的排放,提高了产率,并且所得到的产品纯度高,杂质含量低。
将6-氟-3-哌啶-4-基-1,2-苯并异唑盐酸10g和氢氧化钾2.1g加入到含水10%正丁醇100ml溶液中搅拌,然后加入盐酸羟胺6.6g,升温到70~80℃,保温反应2小时,取样中控原料含量为0.03%。降温到50℃后,加入氢氧化钾12.8g,升温至50~60℃,保温反应4小时,取样中控中间体肟残留小于0.01%。最后降温到室温,过滤分层,有机层滴加浓盐酸调节pH=2,析晶后过滤。烘干得到纯度为99.6%的产品7.5g,其中羟基杂质含量为0.08%,中间体肟含量为0.05%,甲氧基杂质和丁氧基杂质均未检出,总含量为98.7%。
[1]WO2008/108957 A2, ;
本文旨在探讨合成2-氨基噻唑-4-甲酸乙酯的方法。通过深入研究这一合成过程,有望为相关领域的发展提供新的见解和启发。
背景:目前胃肠动力障碍被认为是功能性消化不良的主要病因,因此促胃肠动力药是目前治疗FD的主要药物。常用的促胃肠动力药有多巴胺受体拮抗剂甲氧氯普胺、多潘立酮、伊托必利、左舒必利,5-HT 4 受体激动剂莫沙必利、西沙必利和胃动素受体激动剂,以及乙酰胆酯酶(AChE)抑制剂阿考替胺等。其中阿考替胺是一种新型的、全球第一个获批的FD治疗药物,作为合成阿考替胺(Z-338)过程中所用到的关键中间体2-氨基噻唑-4-甲酸乙酯的合成,合成该化合物的中间体溴代丙酮酸乙酯同时为药物β-受体阻断剂心得静的中间体。该化合物的合成对进一步降低阿考替胺的成本具有重要意义。寻求一种高产物收率的2-氨基噻唑-4-甲酸乙酯的合成方法非要有必要
合成:
1. 方法一:
步骤1、在装有恒压滴液漏斗和温度计的500ml三口瓶中依次加入40g丙酮酸乙酯、190g二氯甲烷、1ml98%d的浓硫酸,搅拌溶液;
步骤2、水浴加热至40℃,搅拌下滴入57.9 g溴素,控制加入速度,待前一滴反应完全即完全褪色后,再加入下一滴,控制反应温度在40℃左右;
步骤3、滴加完后,保温反应30min,减压蒸馏,收集100-120℃的馏分,得溴代丙酮酸乙酯;
步骤4、在装有回流冷凝管的250ml三口烧瓶中加入90.5g溴代丙酮酸乙酯、46.7g硫脲、500g乙醇和2.0g Cu2O@HKUST-1纳米催化剂加热至回流,保温反应3h,反应完毕冷却至室温,减压浓缩至干,得粗品;
步骤5、将残留的固体溶解在900ml冰水中,用K2C03 调pH=8,过滤收集生成的固体,纯水洗涤3次,得医药中间体2-氨基噻唑-4-甲酸乙酯。
2. 方法二:
将2-叠氮基丙烯酸乙酯 7.05g(0.05mo1)、硫氰酸钾 9.72g(0.1mol),150ml 乙醇,七水合硫酸亚铁 6.95g(0.025mol) 加至 250m1反应瓶中搅拌下,加热升温至80℃反应12小时,TLC检测反应液(石油醚:乙酸乙酯=1:1的体积比),2-叠氮基丙烯酸乙酯消失;将所得的反应液冷却至40℃左右,旋转蒸发仪浓缩除去乙醇,残留液加入150ml水,用50mL乙酸乙酯萃取,重复三次,合并有机层(位于上层),依次用 50m 水洗涤,50ml 饱和食盐水洗涤,用无水硫酸钠(5.0g)干燥 30 分钟,转蒸发仪浓缩除去乙酸乙酯,残留液用 40m1乙醇重结晶,得 6.94 克类白色固体,收率:80.6%。
参考文献:
[1] 陈余陆,汪明. 5-氨基-2-苯氨基-噻唑-4-苯甲酸乙酯的合成方法[J]. 科技资讯,2009(19):170-170. DOI:10.3969/j.issn.1672-3791.2009.19.140.
[2] 伍嘉莉,周梦帆,杨龙,等. 2-氨基-4-甲基噻唑-5-甲酸乙酯的合成研究[J]. 精细化工中间体,2020,50(1):16-18. DOI:10.19342/j.cnki.issn.1009-9212.2020.01.004.
[3] 浙江大学. 2-氨基噻唑-4-甲酸乙酯的制备方法:CN201410324135.3[P]. 2014-11-26.
[4] 宁夏法安德药业有限公司. 一种医药中间体2-氨基噻唑-4-甲酸乙酯的合成方法:CN201810334527.6[P]. 2021-03-26.
本文将探讨盐酸阿考替胺三水合物的合成方法,旨在为读者提供深入了解和应用该药物的指导。
简述:目前胃肠动力障碍被认为是功能性消化不良的主要病因,因此促胃肠动力药是目前治疗 FD 的主要药物。常用的促胃肠动力药有多巴胺受体拮抗剂甲氧氯普胺、多潘立酮、伊托必利、左舒必利,5-HT4 受体激动剂莫沙必利、西沙必利和胃动素受体激动剂,以及乙酰胆酯酶 (AChE) 抑制剂阿考替胺等。
阿考替胺是一种新型的、全球第一个获批的FD 治疗药物,盐酸阿考替胺,全称为 N-[2-(二异丙基氨基)乙基]-2-[(2-羟基-4 ,5-二甲氧基苯甲酰)氨基]-1,3-噻唑-4-羧酸胺盐酸盐三水合物,自 2013 年在日本上市以来,受到全球各界的广泛关注。
合成:
1. 方法一:
2,4,5-三羟基苯甲酸(2)与碘甲烷进行烃化反应、水解反应得到2-羟基-4,5-二甲氧基苯甲酸(3),再与2-氨基噻唑-4-甲酸甲酯(4)缩合得到2-[(2-羟基-4,5-二甲氧基苯甲酰基)氨基]噻唑-4-羧酸甲酯(5),然后与N,N-二异丙基乙二胺酰化、与盐酸成盐、精制得盐酸阿考替胺三水合物(1),总收率78.4%。具体实验步骤如下:
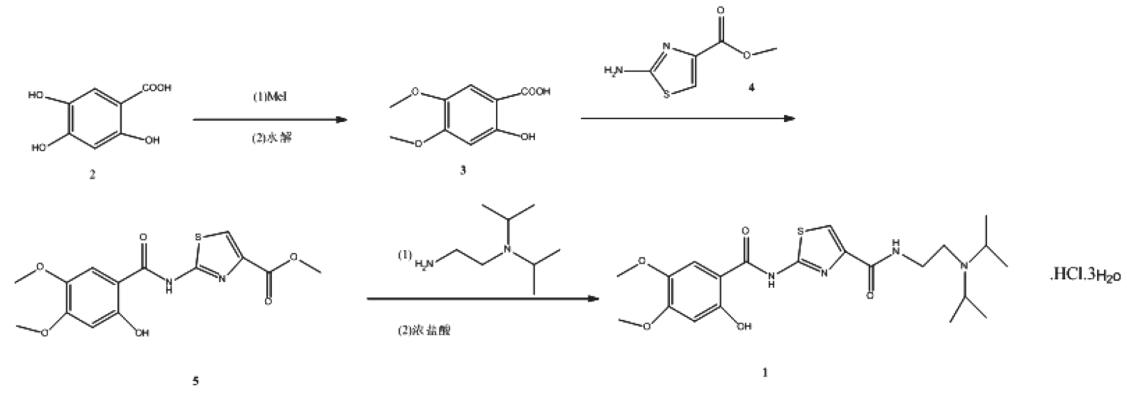
(1)2-羟基-4,5-二甲氧基苯甲酸(3)
在反应瓶中加入2,4,5-三羟基苯甲酸(51.1 g,0.3 moL)、氢氧化钠(40 g,1.0 moL)和乙醇1000mL,搅拌半小时,室温下缓慢滴加62.3 mL碘甲烷(1 moL),滴加完毕后,加热至50℃搅拌反应5小时,TLC显示反应完全。将反应液冷却至室温,加入氢氧化钠(20.0 g,0.5 moL)和水200 mL,维持温度在50℃,搅拌2 h。控制温度10℃以下,滴加3 mol/L稀盐酸(约230 mL)调节pH值至4.5,逐渐析出白色固体,搅拌1h,冷却至室温。抽滤,滤饼加2000mL水,用乙酸乙酯(3×1500 mL)萃取,合并有机层,用水(3×2000 mL)洗涤,40~50℃真空干燥3 h,得白色固体3(54.1 g,91%)。
(2)2-[(2-羟基-4,5-二甲氧基苯甲酰基)氨基]噻唑-4-羧酸甲酯(5)
将3(39.8 g,0.2 moL)、4(34.8 g,0.22 moL)与2,4,6-三氯-1,3,5-三嗪(42.1 g,0.24 moL)悬浮在装有800 mL二氯甲烷的反应瓶中,冰水浴搅拌下滴加三乙胺(50.6 g,0.5 moL)与200 mL二氯甲烷组成的混合溶液,20 min内滴加完毕后继续搅拌0.5小时,然后升温到室温搅拌2小时。停止搅拌,将反应液加到水中打浆,冰浴析晶2 h,过滤,真空干燥,得白色固体(64.9g,96%,以3计),mp246~247℃。
(3)盐酸阿考替胺三水合物(1)
将5(50.9 g,0.15 moL)与1000 mLDMSO置于四颈瓶中,N2气保护下加入N,N-二异丙基乙二胺(43.3g,0.3 moL),加热至110℃反应6小时。停止反应,减压蒸干溶剂。残渣中加入300 mL的正丁醇,然后依次用10%的碳酸氢钠(150 mL)和饱和食盐水(150mL)洗涤。洗涤结束后,保留有机相。向得到的有机相中加入150mL的异丙醇。然后在冰水浴条件下,用浓盐酸(约50 mL)将体系的pH值调至1~2,搅拌4h,析出白色固体。过滤,滤液减压浓缩,将浓缩物加入乙酸乙酯(750 mL),加热至40 ℃待固体全部溶解,自然冷却析晶约2 h,过滤,真空干燥约3h,得白色粉
末状固体1(72.9 g,89.7%),mp194~195℃,纯度99.8%[HPLC归一化法]。
2. 方法二:
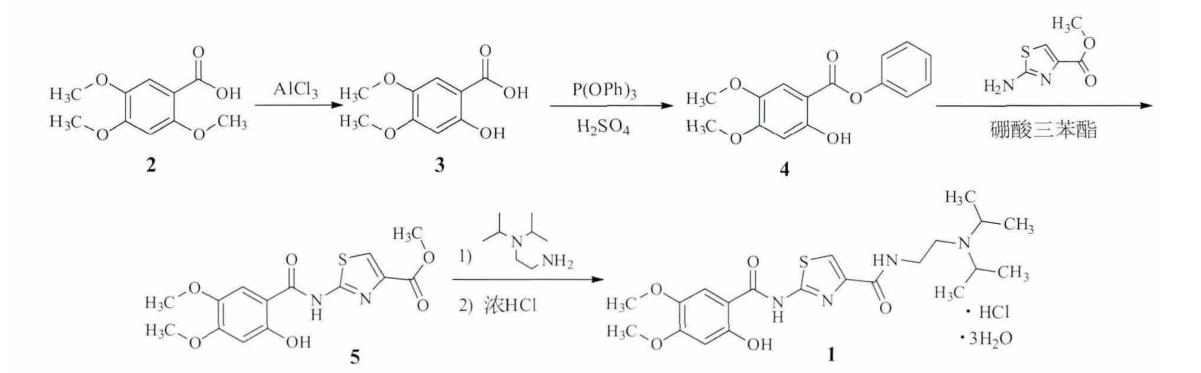
2,4,5-三甲氧基苯甲酸经氯化铝脱甲基得 2-羟基-4,5-二甲氧基苯甲酸,与亚磷酸三苯酯反应生成 2-羟基-4,5-二甲氧基苯甲酸苯酯,再与 2-氨基噻唑-4-甲酸甲酯缩合得 2-[(2-羟基-4,5-二甲氧基苯甲酰基 ) 氨基 ] 噻唑-4-羧酸甲酯,然后与 N,N-二异丙基乙二胺酰化、与盐酸成盐、精制得盐酸阿考替胺三水合物,总收率 75%。合成路线如下:
参考文献:
[1]刘晓莲,马宁宁,杨藏军等. 盐酸阿考替胺三水合物合成工艺研究 [J]. 煤炭与化工, 2023, 46 (04): 119-122+160. DOI:10.19286/j.cnki.cci.2023.04.031.
[2]朱元菊,孙涛,于稳. 盐酸阿考替胺三水合物的合成 [J]. 临床医药文献电子杂志, 2017, 4 (58): 11473-11474. DOI:10.16281/j.cnki.jocml.20171019.003.
[3]白晓光,杨志衡,李子强等. 盐酸阿考替胺三水合物的合成 [J]. 中国医药工业杂志, 2015, 46 (03): 230-232. DOI:10.16522/j.cnki.cjph.2015.03.018.