自问自答
我打算合成一种化合物——左乙拉西坦
这只是一种治疗癫痫的化合物,没有半点不和谐的东西,我也只打算以科研为目的,不会把这个东西投入到谋利中
]
左乙拉西坦(levetiracetam)是比利时ucb制药公司研发的一种新型抗療痫药物,其化学名称为(s) -2-
(2-氧代-1-批咯烧)丁酸胺,英文名为:(s)-2-(2-0xopyrrolidin-l-yl)butananide,分子式为=c8h14n2o2,分子量为
170.21,其化学结构式为:
[0003]

什么原因导致我想去合成这种化合物,说来话长。
去年我回老家,见一个父亲同事的孩子,我叫他哥,这个哥读书成绩不好,读完高中就去打工去了,我读大学,我毕业了他一直在打拼,这么多年下来,找了个老婆,在老家买地皮修了个小二楼,女儿都三岁了。按道理说是小康之家或者幸福的一家子,不过运气不好,小孩有癫痫,偶尔发作。
这两口子先信中医(很正常,家里面有老人的都认为中医能解决问题),开了一堆中药熬水喝,药方蝎子什么的都有,结果不起效果。
然后用西药,ct、脑电图都检查了,没什么异常,医生开了丙戊酸钠。
这个药很便宜,到处都有卖,确实很管用,吃了就几乎不发作了,不过后面抽血化验,转氨酶升高,很简单,这药有肝脏毒性,如果是个大人没有问题,不过是个小孩,按照医生的处方要吃两年,小孩受不了。所以医生建议他们换药,换一种国外的新药,也就是左乙拉西坦。
这个药是比利时公司生产的,是一种新药,投入到临床运用不到,在医院的售价是700块一盒,一盒有30粒左右,刚好可以管一个月,也就是他必须每个月花700块在小孩身上。我这位认识的朋友收入并不低,他两口子月收入在2w+以上,也就是这点钱对他们来说不算什么。
但是其他忍受这个病折磨的人呢?那些月收入低于1000元的人呢?那些没有医保的人呢?
比利时的科学家厉害,你们发明了一种先进的药物,为人类做出了贡献。。。。。。佩服你们。。。。。好了佩服就到这里。。。我打算以研究为目的合成这种化合物,尝试用低成本得到方式合成出来。不管是否合成出来,我都不会把产物投入到临床中去,只是作为合成的实验,然后开源方法和过程。
我只是一个计算机行业的从业者,一个利用业余世界研究的化学爱好者,我只取得过电子通信专业的大学学士学位,没有太多的化学的基础,我的理论只在高中化学的水平上加上一点有限的能材方面的知识。但我希望我的研究能做出一些贡献,可能我中二了一些。。。
这些书籍,是我挑战这个巅峰的弹药,这个项目我可能会持续几年。

http:///patents/cn102558012b?cl=zh
这里也能查到合成方法:
http:///chemical/50456
92.25g(0.5mo1)(s)-2-氨基-4-甲硫基丁酰胺溶于600ml二氯甲烷,在室温加入84g无水硫酸钠。然后冷至0℃,加入115gkoh和8.1g(0.025mo1)四丁基溴化铵在100ml二氯甲烷的溶液。在同样的温度下滴加77.5g(0.55mo1)4-氯丁酰氯在100ml二氯甲烷的溶液,在滴加过程中,不断地加入550ml二氯甲烷以稀释反应液。加毕,在0℃搅拌2h,然后加入29g
koh。再反应4.5h后,再加入29g
koh。过滤,滤液减压浓缩,剩余物经硅胶层析提纯(层开剂为:二氯甲烷-甲醇-氨水,95.5:4.5:0.2μ/μ/μ),得66g(s)-α-[2-(甲硫基)乙基]-2-氧代-1-吡咯烷乙酰胺,为白色粉末,收率61%。
50g raney
ni、386ml水和7g(0.0324mo1)(s)-α-[2-(甲硫基)乙基]-2-氧代-1-吡咯烷乙酰胺加到反应瓶中,在75℃搅拌1h。过滤,减压蒸出水。5.3g剩余物用60ml乙酸乙酯重结晶,得3.87g左乙拉西坦,熔点112~115℃,收率69%。
1. (s)-2-氨基丁酸甲酯的制备
在反应瓶中加入无水甲醇500ml,冷却到-10
?c时滴加ocl2
63.5g(0.53mol)滴毕,于0~5?c下分批加入(s)-2-氨基丁酸50g(0.485mol),加毕,自然升温至室温,搅拌下,当达到室温时,再搅拌反应24h.反应毕,于50?c减压浓缩回收甲醇,得到白色固体l-甲巯氨酸甲酯盐酸盐.加入100ml水溶解,用浓氨水中和至ph8~9,用乙酸乙酯提取,有机层减压浓缩,得无色油状物(s)-2-氨基丁酸甲酯50.3g,收率88.6%.
2. (s)-4-[(1-甲氧羰基)丙基-氨基]丁酸乙酯的制备
在反应瓶中加入异丙醇510ml,搅拌下加入(s)-2-氨基丁酸甲酯50.3g(0.43mol),溶解后加入三乙胺50.0g(0.49mol),油浴加热至回流,滴加95%的4-溴丁酸乙酯98.5g(0.48mol),加毕,搅拌回流24h.[tlc跟踪,展开剂为乙酸乙酯/正己烷(1:1),rf
0.38---原料,rf
0.75---产物].当原料点消失后,反应毕.将反应混合物冷至室温,用6mol/l盐酸调ph至3~4,产生固体,加入二异丙基乙醚后过滤,固体物用饱和nahco3溶液溶解,乙酸乙酯提取,有机层用无水na2so4干燥,过滤,滤液浓缩,得无色油状物(s)-4-[(1-甲氧羰基)丙基-氨基]丁酸乙酯80.0g,收率81%.
3. (s)-2-(2-氧代-1-吡咯烷)丁酸甲酯的制备
在干燥的反应瓶中加入(s)-4-[(1-甲氧羰基)丙基-氨基]丁酸乙酯70.0g(0.3mol)和甲苯350ml,搅拌溶解,再加入2-羟基吡啶1.43g(0.015mol),油浴加热至回流,搅拌回流24h.反应毕,减压浓缩,得棕色油状物(s)-2-(2-氧代-1-吡咯烷)丁酸甲酯53g,收率95%.
4. 左乙拉西坦的合成
在反应瓶中加入甲醇500ml和去离子水33ml,冷却至0?c,搅拌加入50.0g(0.27mol),溶解后通氨气至饱和,密闭反应瓶#在0~5?c下搅拌反应96h[tlc跟踪,展开剂为乙酸乙酯/丙酮(3:1).产物rf=0.28,原料rf=0.6].原料点消失,反应结束,减压蒸馏,得黄色固体左乙拉西坦粗品41.5g,收率90.2%.
将左乙拉西坦粗品41.5g溶于丙酮350ml,搅拌加热溶解,加入活性炭适量,搅拌回流20min,趁热过滤,滤液冷却到0?c析晶,过滤,得左乙拉西坦白色晶体31.1g,收率75%,mp116~117?c.产品纯度(hplc)99.8%,含量99.5%,干燥失重0.3%.
(R)-1-Boc-2-氰基吡咯烷是一种有机中间体,可以通过Boc-D-脯氨酸为原料先制备(2R)-2-氨甲酰基吡咯烷-1-甲酸叔丁酯,然后在氰尿酰氯的作用下得到(R)-1-Boc-2-氰基吡咯烷。

在-78℃下,将N-甲基吗啉(9.85 g,97.5 mmol)和氯甲酸异丁酯(13.3 g,97.5 mmol)加入到Boc-D-脯氨酸(20.0 g,92.9 mmol)的THF(200mL)中,搅拌1小时。随着反应温度升高至室温,缓慢加入氢氧化铵(58mL),并再搅拌2小时。将反应混合物在CH2Cl2和水之间分离。有机萃取液用1M HCl洗涤,用硫酸钠干燥,过滤并浓缩,得到产物(10.8g,54%),为无色半固体。1H NMR (300 MHz, CDCl3): δ (ppm) 5.91-6.13 (m, 1H), 4.17-4.30 (m, 2H), 3.37-3.48 (m, 2H), 2.10-2.18 (m, 2H), 1.84-1.96 (m, 2H), 1.45 (s, 9H).
将(2R)-2-氨甲酰基吡咯烷-1-甲酸叔丁酯(10.81g,50.45mmol)和氰尿酰氯(5.58g,30.3mmol)在DMF(30mL)中搅拌1小时。将反应混合物在乙酸乙酯和水之间分离。有机萃取物用碳酸钠水溶液、用氯化钠水溶涤。用Na2SO4干燥,过滤并浓缩,得到(R)-1-Boc-2-氰基吡咯烷(8.34g,84%),为无色油状物。1H NMR (300 MHz, CDCl3): δ (ppm) 4.42-4.55 (m, 1H), 3.32-3.52 (m, 2H), 200-2.27 (m, 4H), 1.46-1.50 (m, 9H).
[1] From U.S. Pat. Appl. Publ., 20070259926, 08 Nov 2007
2-氯噻吩-3-甲醛是一种有机中间体,可用于制备2-氯-3-噻吩羧酸。噻吩类化合物广泛应用于染料、香料、塑料、溶剂、杀虫剂、化妆品和药品等领域。

首先,将3-甲基噻吩(19.63g)溶解在乙腈(100ml)中,然后逐滴加入硫酰氯(16.64ml)。在室温下搅拌1小时,再在回流下搅拌1小时。冷却至室温后,加入10%硫代硫酸钠水溶液(200ml)。在室温下搅拌2小时,然后用乙醚进行萃取。将萃取液用饱和氯化钠水溶液洗涤,用无水硫酸镁干燥,最后减压浓缩,得到2-氯-3-甲基噻吩(21.52g)。
接下来,将2-氯-3-甲基噻吩(3.53g),N-溴琥珀酰亚胺(4.73g),2,2'-偶氮二(异丁腈)(0.87g)和四氯化碳(25ml)混合物在回流下搅拌4小时。冷却至室温后,通过过滤除去不溶物。减压浓缩滤液,得到2-氯-3-溴甲基噻吩的粗产物。将粗产物和乙酸钾(9.82g)在丙酮(50ml)中的悬浮液在室温下搅拌48小时。将混合物倒入水中并用乙醚进行萃取。萃取液用无水硫酸镁干燥,减压浓缩,得到3-乙酰氧基甲基-2-氯噻吩的粗产物。将粗产物溶解在乙醇(25ml)和四氢呋喃(25ml)的混合物中,并加入1N氢氧化钠水溶液(50ml)。在室温下搅拌30分钟。用1N盐酸酸化水层,并用乙酸乙酯进行萃取。萃取液用无水硫酸镁干燥,并减压浓缩。最后通过硅胶色谱法纯化,减压浓缩得到3-羟甲基-2-氯噻吩(3.22g)。将3-羟基甲基-2-氯噻吩(3.16g)溶解在二氯甲烷(50ml)中,并加入二氧化锰(9.66g)。在室温下搅拌15小时,然后通过过滤除去不溶物。减压浓缩滤液,得到2-氯噻吩-3-甲醛的粗产物(3.16g)。
[1]From PCT Int.Appl.,WO9842347
爱维莫潘作为一种重要的药物,其合成一直是化学领域中备受关注的课题。
简述:爱维莫潘为一种新型的外周 μ 型阿片受体拮抗剂,临床上用于防治手术以及使用阿片类药物导致的胃肠功能紊乱,特发性便秘以及肠易激综合征等,具有疗效确切、不良反应小的优势,其在手术的应用中具有良好的前景。
合成:
1. 方法一:
3-[(3R,4R)-3,4- 二甲基哌啶 -4- 基] 苯酚 (2) 与 2- 苄基丙烯酸乙酯发生 Michael 加成反应,然后通氯化氢气体析晶得(S)-2- 苄基 -3-[(3R,4R)-4-(3- 羟基苯基 )-3,4- 二甲基哌啶-1-基 ] 丙酸乙酯盐酸盐 (3),析晶母液经消旋化循环套用,3 的收率为 60%。3 依次经水解、甘氨酸异丁酯缩合、水解制得爱维莫潘,总收率约45%( 以 2 计 )。具体实验步骤如下:
(1)(S)-2- 苄基 -3-[(3R,4R)-4-(3- 羟基苯基 )-3,4-二甲基哌啶 -1- 基 ] 丙酸乙酯盐酸盐 (3)
将 2(纯度 99.4%,2.0 g,9.74 mmol)、2- 苄基丙烯酸乙酯 (2.04 g,10.72 mmol) 和甲苯(10 ml) 加至 50 ml 反应瓶中,升温回流反应 4 h。冷却至室温,加入乙醇 (14 ml),通氯化氢气体调至 pH 1,搅拌 15 min,浓缩至干。向残留物中加入乙醇 (20 ml),缓慢析出白色固体,搅拌过夜,0 ℃搅拌 1.25 h,过滤,滤饼干燥后加入乙醇 ( 约 5.2 ml)回流打浆 2 h,冷却至室温,0 ℃搅拌 1 h,过滤,干燥得白色固体 3(1.4 g,34% )。乙醇母液浓缩至干,加入乙酸乙酯 (15 ml)和水 (15 ml),加饱和碳酸钠溶液调至 pH 9 ~ 10,室温搅拌 1 h。分取有机相,用水 (10 ml) 洗涤,经水硫酸钠干燥后过滤,滤液浓缩,残留物中加入甲苯 (2.4 ml),升温回流搅拌 8 h。冷却至室温,加入乙醇 (8.5 ml),通氯化氢气体调至 pH 1,搅拌15 min,浓缩至干,加入乙醇 (12 ml) 缓慢析出白色固体,室温搅拌 2 h,0 ℃搅拌 1.25 h,过滤,滤饼干燥后在乙醇 (2.5 ml) 中回流打浆,得白色固体3(0.72 g)。收集母液,再次重复上述游离、消旋、析晶操作,与前面所得 3 合并,共制得 3 2.47 g,收率 60%。
(2)(S)-2- 苄基 -3-[(3R,4R)-4-(3- 羟基苯基 )-3,4-二甲基哌啶 -1- 基 ] 丙酸一水合物 (4)
将 3(7.65 g,17.71 mmol)、水 (70 ml) 和 50%氢氧化钠溶液 (6.1 g) 加至 250 ml 反应瓶中,室温搅拌 10 h。TLC[ 展开剂 :二氯甲烷∶甲醇 (8 ∶ 1)]显示反应完全,过滤,滤液中加入甲醇 (73.4 ml),加浓盐酸 ( 约 10.0 g) 调至 pH 6,析出固体。浓缩除去甲醇,室温搅拌 4 h,加浓盐酸重新调至 pH 6,0 ℃搅拌 1.5 h,过滤,滤饼干燥得白色固体 4(6.65 g,97.4% ),mp 183.3 ~ 185.7 ℃。
(3)2-[[(2S)-2-[[(3R,4R)-4-(3- 羟基苯基 )-3,4- 二甲基哌啶 -1- 基 ] 甲基 ]-3- 苯基丙酰 ] 氨基 ] 乙酸异丁酯 (5)
氮气保护下,将 4(6.65 g,17.2 mmol)、甘氨酸异丁酯对甲苯磺酸盐 (5.91 g,19.5 mmol) 和 1- 羟基苯并三唑 (HOBt,2.63 g,19.5 mmol) 加至 THF(67 ml) 中,控制温度不高于 15 ℃,加入三乙胺(1.97 g,19.5 mmol) 和 EDCI(3.74 g,19.5 mmol),25 ℃反应 4 h。TLC[ 展开剂 :二氯甲烷∶甲醇(8 ∶ 1)] 显示反应完全,加入乙酸乙酯 (83 ml)稀释,依次用 0.5 mol/L 的碳酸钠 - 碳酸氢钠溶液(pH ≈ 10,83 ml,称取碳酸钠 19.08 g、碳酸氢钠 26.88 g,加水定容至 1 L 即得 )、饱和氯化钠溶液 (83 ml) 和水 (83 ml) 洗涤,减压浓缩,得浅黄色油状液体 5(8.54 g,100% )。
(4)爱维莫潘 (1)
将 5(8.29 g,17.25 mmol) 加入乙醇 (209 ml)和水 (49 ml) 的混合溶剂中,控制温度小于 25 ℃,加入 1 mol/L 氢氧化钠溶液 (51.7 ml),25 ℃搅拌45 min,TLC[ 展开剂 :二氯甲烷∶甲醇 (5 ∶1)]显示反应完全。加浓盐酸调至 pH 6,析出固体,浓缩除去乙醇,室温搅拌 2 h,0 ℃搅拌 1.5 h,过滤,干燥,所得 1 粗品 (6.93 g) 经乙醇∶水 (2∶1) 重结晶,得白色固体粉末 1(6.2 g,78% ),mp207.6~208.7 ℃。纯度 99.9%。
2. 方法二:
(1)3-[(3R,4R)-3,4- 二甲基哌啶 -4- 基 ] 苯酚(4)的合成
3- 溴苯酚 (5) 在碳酸钾作用下与 2- 溴丙烷反应得到异丙基 -3- 溴苯醚 (6),6 先与镁发生格氏反应,后与1,3-二甲基哌啶-4-酮反应得到(3S,4R)-1,3-二甲基 -4-[3-(1- 甲基乙氧基 ) 苯基 ]-4- 哌啶醇(7),7 与氯甲酸乙酯反应,经对甲基二苯甲酰酒石酸 [(+)-DTTA] 拆分生成碳酸 -(3S,4R)-1,3- 二甲基 -4-[3-(1- 甲基乙氧基 ) 苯基 ]-4- 哌啶乙酯(8),8 在十氢萘作用下加热得到 (3R)-1,3- 二甲基 -4-[3-(1- 甲基乙氧基 ) 苯基 ]-1,2,3,6- 四氢吡啶(9),9 在正丁基锂作用下与硫酸二甲酯发生甲基化反应得到(3R)-1,3,4-三甲基-4-[3-(1-甲基乙氧基)-苯基 ]-1,2,3,4- 四氢吡啶 (10),10 先经硼氢化钠还原,后经 (+)-DTTA 拆分得到 (3R,4R)-1,3,4- 三甲基 -4-[3-(1- 甲基乙氧基 ) 苯基 ] 哌啶 (11),11 与氯甲酸苯酯反应得到 (3R,4R)-3,4- 二甲基 -4-[3-(1-甲基乙氧基 ) 苯基 ] 哌啶甲酸苯酯 (12),12 经酸水解得到 4 。
(2)爱维莫潘的合成
3-[(3R,4R)-3,4- 二甲基哌啶 -4- 基 ] 苯酚(4)与丙烯酸甲酯 (30) 加成得到 (3R,4R)-4-(3-羟基苯基 )-3,4- 二甲基 -1- 哌啶丙酸甲酯 (31),31先在二异丙基氨基锂 (LDA) 作用下,与苄基溴反应,再经盐酸酸化得到 (2S)-2-[[(3R,4R)-4-(3-羟基苯基 )-3,4- 二甲基哌啶 -1- 基 ] 甲基 ]-3- 苯基丙酸甲酯盐酸盐 (32),32 经水解得到 (2S)-2-[[(3R,4R)-4-(3-羟基苯基)-3,4-二甲基哌啶-1-基]-甲基 ]-3- 苯基丙酸一水合物 (33) [2] 。33 经三乙胺、DCC、1- 羟基苯并三唑 (HOBt) 作用与甘氨酸乙酯盐酸盐 (34) 反应得到 2-[[(2S)-2-[[(3R,4R)-4-(3-羟基苯基 )-3,4- 二甲基哌啶 -1- 基 ] 甲基 ]-3- 苯基丙酰 ] 氨基 ] 乙酸乙酯一水合物 (35),35 经水解得到爱维莫潘。
参考文献:
[1]王家会,赵传猛,张福利. 爱维莫潘的合成 [J]. 中国医药工业杂志, 2015, 46 (08): 799-802. DOI:10.16522/j.cnki.cjph.2015.08.001.
[2]石权达,闫冬,高静等. 爱维莫潘关键中间体的合成 [J]. 中南药学, 2015, 13 (05): 490-493.
[3]王家会,包如胜,裘鹏程等. 爱维莫潘合成路线图解 [J]. 中国医药工业杂志, 2014, 45 (03): 291-294. DOI:10.16522/j.cnki.cjph.2014.03.025.
本文介绍了如何使用2-氟碘苯来合成2-氟-3-碘苯胺,旨在为相关研究人员提供参考依据。
简介:2-氟碘苯是一种有机化合物,可用于制备苯胺衍生物2-氟-3-碘苯胺。2-氟-3-碘苯胺是一类苯胺衍生物,可以用来合成抗忧郁、抗肿瘤、和抗菌的药物等。
合成2-氟-3-碘苯胺:
邵东等人以2-氟碘苯为起始原料引入羧基,然后发生重排,最后脱-BOC得到2-氟-3-碘苯胺。该方法简便、易操作,适合于大量制备。具体步骤如下:
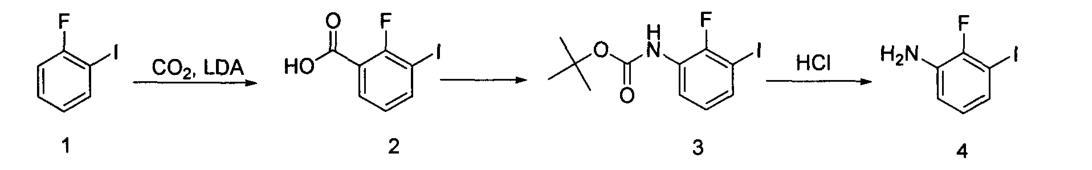
步骤1:合成2-氟-3-碘苯甲酸(化合物2)
将13毫升(91.0毫摩尔)的二异丙基胺溶解于100毫升四氢呋喃中,并在氮气保护下,于-20℃滴加36.4毫升(91.0毫摩尔)的2.5M正丁基锂溶液。滴加完毕后,在0℃搅拌30分钟。随后,以四氢呋喃(50毫升)为溶剂,滴加18.4克(82.8毫摩尔)的2-氟碘苯,继续在-70℃搅拌1小时。加入50克干冰,使温度自然升至室温并过夜搅拌。向上述反应混合物中加入100毫升水,然后分离有机相。将水相用浓盐酸酸化至pH1~2,进行乙酸乙酯萃取三次,最后经过无水硫酸钠干燥。减压浓缩后,得到15.5克黄色固体(2),产率为70.5%。
步骤2:合成2-氟-3-碘苯基氨基甲酸叔丁酯(化合物3)
将化合物(2)(13.3g,50.0毫摩尔)、三乙胺(20.8毫升,150.0毫摩尔)和DPPA(26.7g,100.0毫摩尔)溶解于叔丁醇(50毫升)和甲苯(50毫升)中,加热至80℃并搅拌过夜。经减压蒸馏后,残留物进行硅胶柱层析(使用200~300目的石油醚∶乙酸乙酯溶液,比例为100∶1~20∶1),最后通过真空干燥,得到9.31克无色液体(3),产率为55.3%。
步骤3:合成2-氟-3-碘苯胺(化合物4)
将化合物(3)(9.31g,27.7毫摩尔)溶解于甲醇(50毫升)中,加入浓盐酸(10毫升),并在室温下搅拌3小时。随后进行减压蒸馏除去甲醇,然后将产物溶液进行碱化至pH8~9,使用饱和碳酸氢钠溶液。接下来进行乙酸乙酯萃取和无水硫酸钠干燥。最后进行减压浓缩,得到6.6克灰白色固体(4),产率为100%。
参考文献:
[1]王利杰.含水杨醛缩酰肼、苯胺衍生物的二芳烯的合成及其性能研究[D].江西科技师范大学,2021.DOI:10.27751/d.cnki.gjxkj.2021.000139
[2]苏州科捷生物医药有限公司. 2-氟-3-碘苯胺的制备方法:CN201310189885.X[P]. 2013-08-14.
在有机合成中,O-叔丁基-N,N'-二异丙基异脲是一种常用的有机中间体。它可以通过叔丁醇和N,N′-二异丙基碳二亚胺的反应制备得到。

首先,在经过加热干燥并在氮气下的烧瓶中,将27mg无水氯化亚铜(I)加入到2.33g叔丁醇和3.44gN,N′-二异丙基碳二亚胺中。然后,在室温下搅拌2小时,并放置三天。最后,将得到的粗产物用于酯化反应,得到叔丁酯。
在室温条件下,将DIC(2.52g,1.0当量)和叔丁醇(1.8g,1.2当量)的混合物置于圆底烧瓶中,并加入催化剂CuCl的适量。然后,在N2保护下搅拌4天,得到墨绿色的化合物粗品,可直接用于下一步反应。
O-叔丁基-N,N'-二异丙基异脲可用于制备一种具有降压和细胞保护作用的化合物(2S,3aS,7aS)-1{(S)-N-{(S)-1-(邻甲酸甲酯苯氧基羰基)丁基}丙氨酰}八氢-1H-吲哚-2-羧酸。
具体合成步骤如下:
步骤1:将培哚普利(1.0当量)溶解于无水THF(10ml)中,在N2保护下室温加入O-叔丁基-N,N'-二异丙基异脲(3.5当量),室温搅拌2天,使用TLC板监测反应的结束。将反应液中的不溶物滤掉,旋出THF,乙酸乙酯稀释后,分别用2mol/l的氨水、水、饱和食盐水洗涤,干燥,浓缩后使用硅胶柱层析法纯化得到纯品。
步骤2:将(2S,2aS,7aS)-1{(s)-N-[(s)-1-乙酯基丁基]丙氨酰}八氢-1H-吲哚-2-羧酸叔丁酯(200mg)溶解于甲醇(2ml)中,滴加1mol/ml的氢氧化钠溶液,使用TLC监测反应的结束后,使用饱和柠檬酸中和反应液,浓缩甲醇,使用1mol/l氢氧化钠溶液调节pH至碱性,使用乙醚萃取有机杂质两次,使用饱和柠檬酸酸中和水相,最后使用EtOAc/THF(2∶1)进行萃取,使用硅胶柱纯化得到产品。
步骤3:将上一步得到的产物与(Boc)2O(1.2当量)、DMAP(2.0当量)和DCM(c=0.1-0.2mmol/ml)在室温下搅拌2小时,使用点板检测(DCM∶MeOH=10∶1)来监测反应的结束。当原料反应完全后,直接在室温条件下加入水杨酸甲酯(1.0当量)和DCC(1.2当量),继续搅拌过夜。使用点板检测(PE∶EA=2∶1,产物Rf=0.8)来确认反应的完全性,然后进行后处理柱层析纯化得到产品。
步骤4:将上一步得到的产物溶解于DCM(c=0.2mmol/ml)中,加入TFA(11当量),在0~10℃下搅拌过夜,使用点板检测常规后进行处理柱纯化得到产品。
最终产物的1HNMR(400MHz,CDCl3)谱图如下:
δ9.65-9.27(m,1H),8.03(dd,1H),7.68-7.51(m,1H),7.37(dt,1H),7.27-7.01(m,2H),4.90-4.70(m,1H),4.54(d,1H),4.44-4.28(m,1H),4.11(dd,1H),4.04-3.92(m,1H),3.90-3.73(m,2H),2.42(s,1H),2.15(dd,4H),1.86-1.34(m,11H),1.31-1.06(m,3H),1.00(dt,3H)。[M+H]+=475.2458。
[1][中国发明]CN201880039047.5除草活性的四氢和二氢呋喃羧酸和酯的3-苯基异噁唑啉-5-甲酰胺
[2][中国发明,中国发明授权]CN201410312148.9一种新的具有降压和细胞保护作用的化合物
Fmoc-L-苏氨酸作为一种重要的氨基酸衍生物,具有广泛的应用价值。本文将探讨Fmoc-L-苏氨酸的具体应用,以供相关研究人员参考。
背景:Fmoc-L-苏氨酸是一种氨基酸衍生物,可用于生化试剂,多肽合成。L-苏氨酸的侧链羟基在液相肽合成时一般不用保护,但当羧基被活化或缩合反应较慢以及羧基组分过多时,也会发生副反应。在固相合成中一般使用过量的羧基组分。因此,一般把侧链羟基加以保护来减少副反应,保护基有苄基(Bzl)、叔丁基、酰基等保护基。苏氨酸的氨基保护,采用对碱敏感的保护基9-芴甲氧羰酰基(Fmoc)来保护,而羟基的保护一般选择对酸敏感的保护基叔丁基(tBu)比较好。
O-叔丁基的除去,可以用盐酸/三氟乙酸(室温30 min)、三氟乙酸(室温数小时)或浓盐酸(0 ℃时10 min)等酸解。9-芴甲氧羰基(Fmoc)为对碱敏感保护基,可用浓氨水或二氧六环-甲醇-4 mol/L NaOH(体积比30∶9∶1 )及哌啶、乙醇胺、环己胺、1 ?4-二氧六环、吡咯烷酮等氨类的50%二氯甲烷溶液除去。L-苏氨酸的保护合成往往是用相应的氨基酸甲酯盐酸盐在酸催化下与异丁烯反应?然后与9-芴甲氧羰基琥珀酰亚胺(Fmoc - OSu)反应,并脱去相应的甲酯生成全保护的Fmoc- Thr(tBu)-OH。
应用:可合成L-苏氨醇。随着多肽类药物的迅速发展,L-苏氨醇(1)已广泛应用于各种醇肽的固相合成,如生长激素抑制素somatostatin、奥曲肽(octreotide)和Tyr3- 奥曲肽等。1还可作为不对称金属催化的手性配体,也是核苷酸类药物的原料,用于合成修饰寡核苷酸、脂肪族核苷或核苷类似物、含有甲基红片段的氨基磷酸酯等。
Fmoc-L-苏氨酸与N-甲基吗啉和氯甲酸异丁酯反应后经硼氢化钠还原、脱除Fmoc保护基可得到L-苏氨醇,总收率8 3%,光学纯度99%。具体步骤如下:
(1)Fmoc-L-苏氨醇(3)
2(5.3g,15.6mmol)溶于THF(90ml),冰浴冷却,依次加入N-甲基吗啉(1.7ml,15.6mmol)和氯甲酸异丁酯(2.2ml,17.2mmol),10min后过滤,滤饼用THF洗,合并滤液和洗液,0℃加入硼氢化钠(0.96g,25mmol)的水(10ml)溶液,室温搅拌反应,TLC跟踪反应,约3h结束。加水(250ml)稀释,用乙酸乙酯(150ml×3)萃取,萃取相依次用饱和碳酸氢钠溶液(100ml×3)、1mol/L盐酸(100ml×2)和饱和食盐水(150ml)洗,用无水硫酸镁干燥,过滤,滤液减压蒸干,剩余物用正己烷-乙酸乙酯(3∶1)重结晶,得到3(4.4g,86.3%),mp 103~104℃。
(2)L-苏氨醇(1)
3(3g,9.1mmol)和吗啉(10ml,115mmol)室温搅拌反应30min,转入冰水(200ml)中再搅拌 30min,过滤,滤液蒸干,剩余油状物冻干后得到无色晶体1(0.9g,96.5%),mp:49~51℃。
参考文献:
[1]何洪华;龚大春;李鑫;韦萍. L-苏氨醇的合成 [J]. 中国医药工业杂志, 2005, (06): 326-327.
[2]章平泉;杜秀敏;郭成. 保护L-丝氨酸和L-苏氨酸的合成 [J]. 江苏化工, 2004, (01): 34-36.
[3]王玲. 保护氨基酸的制备研究[D]. 南京工业大学, 2003.
3-氨基-2,6-哌啶二酮盐酸盐是一种重要的化合物,本文旨在介绍有效的合成方法,帮助读者掌握合成3-氨基-2,6-哌啶二酮盐酸盐的技术。
简述:3-氨基-2,6-哌啶二酮盐酸盐,英文名称:2,6-Dioxopiperidine-3-ammonium chloride,CAS:24666-56-6,分子式:C5H9ClN2O2。3-氨基哌啶-2,6-二酮盐酸盐是一种用于制备来那度胺的试剂,它能够诱导del(5q)MDS中的CK1α泛素化和降解。此外,它还可用于合成邻苯二甲酰亚胺共轭物,这些物质能够促进配体依赖性靶蛋白的降解。
合成:
1. 方法一:
以N-Boc-L-谷氨酰胺为原料,制得3-氨基-2,6-哌啶二酮盐酸盐,具体步骤如下:
(1)化合物(5)的合成:
将N-Boc-L-谷氨酰胺(4)246.0 g(1.0 mol)、N, N'-羰基二咪唑(CDI)168.6 g(1.04 mol)置于800 mL四氢呋喃中,加热回流反应16h。自然冷却至室温,析出固体,过滤收集滤饼,经甲醇重结晶,过滤,洗涤,真空干燥得到152.8 g白色固体(5),收率为67%。
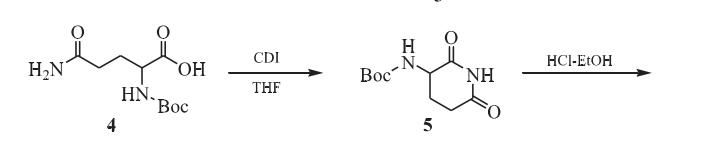
(2)3-氨基哌啶-2,6-二酮盐酸盐(6)的合成
将114.1 g(0.5 mol)中间体5、250 mL盐酸乙醇溶液置于反应瓶中,室温搅拌反应12 h。过滤,乙酸乙酯洗涤,真空干燥得77.1 g白色固体(6),收率为94%。
2. 方法二:
以L-谷氨酰胺为原料,经氨基保护、缩合闭环、氨基脱保护得中间体3-氨基-2,6-哌啶二酮盐酸盐。具体步骤如下:
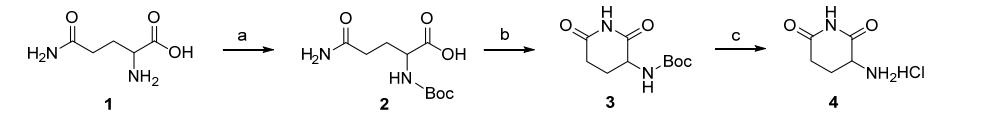
(1)N-(叔丁氧羰基)-L-谷氨酰胺(2)的合成
14.6 g L-谷氨酰胺溶解于100.0 mL 1.0 mol?L-1的NaOH溶液,冰浴下缓慢滴加21.8 g二碳酸二叔丁酯。撤走冰浴,室温下搅拌过夜。反应结束后用硫酸氢钾调 pH=1~1.5,用500 mL乙酸乙酯分3次萃取,合并有机相,用无水硫酸钠干燥,减压旋干,得19.5 g油状物,产率79%。可直接投下一步。
(2)N-(2,6-哌啶二酮-3-基)氨甲酸叔丁酯(3)的合成
19.0 g 化合物2、17.8 g EDCI和12.6 g HOBt溶于 200 mL乙腈中,室温下缓慢滴加15.7 g三乙胺。将反应溶液转移至油浴中回流24 h。反应结束后,旋干溶剂,加入500 mL水,室温搅拌1 h,抽滤,用大量清水洗涤滤饼,再用少量无水乙醇冲洗,抽干,得7.2 g白色固体,产率41%. m.p. 214.4~214.5 ℃
(3)3-氨基-2,6-哌啶二酮盐酸盐(4)的合成
用5.0 mL 1,4-二氧六环将1.4 g N-(2,6-哌啶二酮-3- 基)氨甲酸叔丁酯溶解,加入30 mL 2.0 mol?L-1的1,4- 二氧六环盐酸溶液,室温下搅拌4 h. 过滤,用少量乙酸乙酯洗涤滤饼,抽干,得0.99 g白色固体,产率98%。
参考文献:
[1]黄道伟,周爱南,刘育等. 泊马度胺的合成工艺改进 [J]. 中国药物化学杂志, 2015, 25 (03): 182-184. DOI:10.14142/j.cnki.cn21-1313/r.2015.03.004
[2]陈衍炽,任玉杰. α-(异吲哚啉酮-2-基)戊二酰亚胺含氟类似物的合成与白血病细胞K562抑制活性 [J]. 有机化学, 2015, 35 (05): 1123-1130.
异丙硫醇,又名硫代异丙醇、2-巯基丙烷,其化学式和分子量分别为C3H8S,76.161。常温常压下,异丙硫醇表现为无色透明液体,与乙醇和乙醚混溶,易溶于丙酮,微溶于水。另外,需要注意该物质高度易燃,对于眼睛和皮肤均具有刺激性。

密度:0.82g/cm3
熔点:-131℃
沸点:57-60℃
闪点:-34.4℃
折射率:1.426(20℃)
精细化学品合成技术领域公开了一种异丙硫醇的合成新方法。该方法以2-溴丙烷,硫脲为主要原料,以介孔分子筛材料为载体,经表面化学修饰,负载适当链团结构的季铵盐为相转移催化剂。在有机溶剂中,常压下30~70℃反应3~10小时,生成中间体S-烷基异硫脲盐。然后通氮气除去未反应的2-溴丙烷,再用高沸点的有机胺与中间体S-烷基异硫脲盐进行裂解反应,常压蒸馏得产品异丙硫醇。与目前方法相比,本方法具有原料易得,反应条件温和,工艺过程简单,工艺流程短,催化剂活性高,选择性较好,易于从反应体系回收并可循环使用,产品纯度高,收率高等优点。另外,该方法符合绿色化学思想,对节约能源,降低投资,减少环境污染等十分有利,具有较好的应用前景[1].
利用GC9800TFP型气相色谱仪分析异丙硫醇含量。结果表明:在柱温50℃、汽化室温度150℃、检测器温度150℃、载气流速1.4 mL/min、分流比50∶1、进样量2 μL的条件下,色谱分离效果好。以峰面积外标法定量,测得精密度实验的标准偏差为7.12×10-4,回收率在98.75%~101.25%之间。外标法不需要校正因子,准确性较高,操作简单,适用于大批量试样的快速分析[2].
异丙硫醇主要用作溶剂、有机合成中间体。此外,综合文献,该物质在电子材料、工业制剂等领域也有一定用途。
例如,以异丙硫醇、硝基邻苯二甲酰亚胺、富马酸树脂、二氧化钛、苯磺唑酮、9?亚芴基乙酸乙酯、苯并环丁烯树脂16?47等为原料可以合成一种高熔点电子材料[3].
另有一公开的苯并唑类防紫外线整理剂,包括如下重量份数的成分:5-氨基苯并唑12-20份,2-硝基苯并噻唑-6-乙酸10-15份,2-丁酮3-9份,钛酸四丁酯6-15份,异丙硫醇2-6份,二甲苯磺酸钾5-9份,乳酸钠3-7份,甘油磷酸酯8-12份,乙二醇20-25份,去离子水35-45份。研究表明,利用该整理剂处理过的衣物具有优良的防紫外线效果,且持续时间长,能够更好适应人们的需求[4].
[1]李华,章亚东,郭峰,等.一种异丙硫醇的制备方法:CN 200910172645[P].CN 101704772 B.
[2]李华,张珍,郭峰,等.气相色谱外标定量法分析异丙硫醇含量[J].化学试剂, 2008.DOI:CNKI:SUN:HXSJ.0.2008-11-009.
[3]陆建平.高熔点电子材料:CN201810592936.6[P].CN108587074A.
[4]钱华.一种苯并唑类防紫外线整理剂及其制备方法:CN201610112646.8[P].CN105586769A.