阿伐他汀钠是一种全合成、高选择性的药物,能有效抑制HMG-CoA还原酶,属于第三代他汀类药物。其主要用途是治疗高胆固醇血症、高血脂以及冠心病和脑中风。然而,目前阿伐他汀钠的制备工艺还不够成熟,主要以片剂形式存在,而胶囊剂则具有崩解快、生物利用度高、存储携带方便等优点。因此,研究出一种含阿伐他汀钠的胶囊及其制备方法具有重要的临床应用和广阔的市场前景。
阿伐他汀钠是一种他汀类血脂调节药,属于HMG-CoA还原酶抑制剂前体。
为了提高阿伐他汀钠的纯度,我们提出了一种改进的制备方法。具体步骤如下:将阿托伐他汀叔丁基酯(式II)在醇溶剂中进行碱解,得到阿伐他汀钠(式I)。碱解反应可以使用氢氧化钠或碱性钠盐。首先,将阿托伐他汀叔丁基酯溶解在醇溶剂中,制成质量浓度为20%-40%的溶液,然后加入碱性水溶液,并持续搅拌直至析出白色沉淀,该白色沉淀即为阿伐他汀钠。碱解反应结束后,静置1~3小时,然后通过过滤得到阿伐他汀钠固体,用蒸馏水洗涤沉淀,并进行干燥。
反应过程如下:

[1] CN201010610883.X阿伐他汀钠的制备方法
[2] CN201210495664.0一种含阿伐他汀钠的胶囊及其制备方法
[3] 常用新药精汇手册
在选择产品时,我们通常会了解其功效和禁忌,并根据自身症状进行选择。有些消费者会在购买药品前进行全面检查,并在医生指导下购买。那么,阿伐他汀钠的销售价格是多少呢?
阿伐他汀钠是一种化学物质,市面上的销售价格为160元。购买时应选择正规合法的渠道,以确保产品质量。一些消费者选择线下专卖店购买,认为优惠力度很大,能够第一时间使用该化学物质。还有一些消费者选择网上平台购买,认为网购非常方便,不仅可以直接邮寄到家,还能节约时间。但在购买过程中,我们应学会辨别产品真伪,避免盲目购买或听从他人建议。
此外,在使用阿伐他汀钠期间,应严格按照操作流程使用,避免盲目使用导致眼睛和皮肤灼伤。建议在通风良好的环境下使用,工作场所禁止吸烟、饮酒和进食。
以上已经介绍了阿伐他汀钠的销售价格,有兴趣的消费者可以私下了解更详细的内容。在我们的生活中存在许多化学品,选择时应根据实际需求,并掌握正确的使用方法和用量,严格按照操作流程使用。
阿伐他汀钠是一种用于降低血脂和预防心血管疾病的药物原料。在阿伐他汀钠制剂的生产中,原料采购是一个非常关键的环节。下面从市场规模和上下游采购情况两个方面,对阿伐他汀钠原料采购进行分析。
一、市场规模
阿伐他汀钠原料市场规模较大,主要分布在国内外一些大型药品原料生产企业和销售商之间。据市场调查数据显示,全球阿伐他汀钠市场规模持续增长,预计到2026年将达到62亿美元。国内市场也呈现出较快的发展趋势,市场规模逐年扩大,预计未来将继续保持增长。
二、上下游采购情况
阿伐他汀钠原料的采购主要涉及到上游供应商和下游制剂企业。在上游供应链中,阿伐他汀钠的主要原料为黄芪酸,采购渠道主要包括国内外原料供应商和交易平台。在下游制剂企业中,阿伐他汀钠的主要生产厂家为诺华、辉瑞、拜耳等知名企业。这些企业在原料采购中会考虑到质量、价格、供应稳定性等因素,与上游供应商建立长期稳定的合作关系,从而保证原料的质量和供应的稳定性。
需要注意的是,阿伐他汀钠原料生产存在一定的环保问题,因为生产过程会产生一些有害物质,如有机废水和废气等。因此,在原料采购中,企业需要关注原料的环保性和可持续性,选择符合环保要求的原料供应商,从源头上控制环境污染。
综上所述,阿伐他汀钠原料采购市场规模较大,上下游采购情况也比较复杂。在采购过程中,企业需要综合考虑原料质量、价格、供应稳定性、环保性等因素,与上下游企业建立长期合作关系,实现互利共赢。
心脑血管疾病一直被认为是威胁人类健康的头号杀手。根据相关调查报告显示,每年有超过300万人在我国死于心脑血管病,占总死亡人数的50%。而且,75%的幸存者在不同程度上丧失劳动能力,4%成为重度残疾人士。
阿伐他汀是一种新一代他汀类降血脂药,适用于常见的高胆固醇血症或以血液胆固醇升高为主的混合型高备脂症,特别适用于对其他药物无反应的难治性高胆固醇血症。与其他他汀类药物不同,阿伐他汀只需单一治疗即可发挥作用。因此,自从阿伐他汀上市以来,其销售量迅速增长,成为他汀类药物中的佼佼者。阿伐他汀钠通常只作为合成阿伐他汀钙的中间体。
有研究开发了一种用结晶型阿伐他汀钠制备无定型阿伐他汀钙的方法。该方法包括以下步骤:1)将结晶型阿伐他汀钠与水饱和的正丁醇、异丁醇、丁酮、2-甲基四氢呋喃或醋酸乙酯混合悬浮,2)滴加醋酸钙水溶液并继续搅拌反应,3)分离水层并用水洗涤,4)减压浓缩脱溶剂得到无定型阿伐他汀钙。该方法无需过滤,只需分层和浓缩操作,使用水饱和的溶剂,可以高效地制备无定型阿伐他汀钙。
另外,还有一种制备高纯度阿伐他汀钙的方法。该方法包括以下步骤:1)制备阿伐他汀钠溶液,2)制备钙盐溶液,3)将阿伐他汀钠溶液加入预热的醋酸钙溶液中,保温后过滤和干燥。通过这种方法制备的阿伐他汀钙含量可达99.2%以上,单一杂质小于0.1%,可以满足高品质阿伐他汀钙的要求。
一种制备高纯度结晶型阿伐他汀钠的方法包括以下步骤:1)制备无定型阿伐他汀钠晶体,2)将无定型阿伐他汀钠晶体溶解于含水的醇类溶剂中,滴加丙酮或丁酮,降温结晶后过滤和干燥。通过这种方法可以制备高纯度的A型或B型结晶型阿伐他汀钠。

[1] CN200510060395.5高纯度结晶型阿伐他汀钠的制备方法
[2] CN200710069869.1一种用结晶型阿伐他汀钠制备无定型阿伐他汀钙的方法
[3] CN200510060396.X高纯度阿伐他汀钙的制备方法
氟伐他汀是第一个全化学合成的降胆固醇药物,为羟甲戊二酰辅酶A(HMG-CoA)还原酶抑制剂,可将HMG-CoA转化为3-甲基-3,5-二羟戊酸。可降低血总胆固醇、LDL胆固醇和甘油三酯,呈剂量依存性线性趋势。基于对LDL胆固醇的影响,氟伐他汀比阿托伐他汀低12倍,比瑞舒伐他汀低46倍[1]。

图1 氟伐他汀实物图
氟伐他汀的作用部位在肝脏,具有抑制内源性胆固醇的合成,降低肝细胞内胆固醇的含量,刺激低密度脂蛋白(LDL)受体的合成,提高LDL微粒的摄取,降低血浆总胆固醇浓度的作用。对年龄35-75岁患轻-中度胆固醇血症(基线LDL-C为115-190mg/dl,或3.0-4.9mmol/l)及冠状动脉性心脏病(CHD)的男、女患者,采用定量冠状动脉造影术进行该品对冠状动脉粥样硬化的研究。这是一个随机,双盲,安慰剂对照的临床研究,429例患者除标准治疗外还给予氟伐汀那20毫克每日两次或安慰剂在基线时和两年半时分别进行血管造影加以评估。基于每个病人前、后最新管腔直径(MLD,主要终点),狭窄白粉直径或形成新病变的变化而言,氟伐汀钠显著减慢了冠状动脉病变的进展。
氟伐他汀治疗未能完全控制的原发性高胆固醇血症和原发性混合型血脂异常(Fredricksonlla和llb型)。
已知对氟伐他汀或药物的其他任何成分过敏的或者。活动性肝病或持续地不能解释的转氨酶升高。怀孕和哺乳期妇女以及未采取可靠避孕措施的育龄妇女。严重肾功能不全(肌酐大于260pumol/l,肌酐清楚率小于30ml/min)的患者。
由于在18随以下年龄组缺乏使用氟伐他汀的临床经验,18岁以下患者不推荐使用本品。
意外过量服用氟伐他汀的患者建议给予活性炭口服。如果服进时间较短,可考虑洗胃,需对症治疗。
[1]殷安康. 氟伐他汀降脂疗效的临床观察[J]. 实用临床医药杂志, 2001, (6): 533.
3-脱氧-1,2-O-异丙叉-D-呋喃木糖是一种重要的手性中间体,可用于合成阿托伐他汀等药物。本文将介绍一种制备3-脱氧-1,2-O-异丙叉-D-呋喃木糖的方法。
1,2-O-亚异丙基-α-D-呋喃木糖是制备3-脱氧-1,2-O-异丙叉-D-呋喃木糖的原料。3-脱氧-1,2-O-异丙叉-D-呋喃木糖是合成阿托伐他汀等药物的关键中间体。阿托伐他汀钙片是一种常用的降血脂药,能显著降低胆固醇和甘油三酯水平。
结构

以下是制备3-脱氧-1,2-O-异丙叉-D-呋喃木糖的步骤:
1. 向500mL圆底烧瓶中加入D-木糖(15.0g,0.1mol)和无水硫酸铜(34.4g,0.216mol)。
2. 加入150mL丙酮和3mL的98%浓硫酸,于室温下搅拌反应。
3. 反应24小时后,减压抽滤得到黄色透明液体。
4. 向滤液中滴加浓氨水至pH-7.0,中和硫酸,生成白色絮状沉淀(NH4)2S04。
5. 过滤(NH4)2S04,洗涤滤饼,得无色液体。
6. 用旋转蒸发仪旋干(温度≤50℃),浓缩得黄褐色糖浆状物质。
7. 将上一步得到的二丙酮叉D-木糖中加入100mL的0.1mol·L-1稀盐酸,反应1.5小时。
8. 加入固体碳酸氢钠调至pH7.2~7.5,倒入分液漏斗中,加入乙醚,分层分离。
9. 重复洗涤两次,用旋转蒸发仪旋干(温度≤50℃),浓缩得无色糖浆状1,2-O-亚异丙基-α-D-呋喃木糖。
通过对1,2-O-亚异丙基-α-D-呋喃木糖的化学反应,可以制备出3-脱氧-1,2-O-异丙叉-D-呋喃木糖。这种化合物是合成阿托伐他汀等药物的重要中间体。
[1][中国发明]CN201610661280.X一种3-脱氧-1,2-O-异丙叉-D-呋喃木糖的合成方法
阿托伐他汀钙是一种重要的药物,(4R,6R)-6-氰甲基-2,2-二甲基-1,3-二氧六环-4-乙酸叔丁酯是阿托伐他汀钙重要的中间体,其合成方法具有一定的研究意义。
背景:阿托伐他汀钙是一种高效血脂调节药。
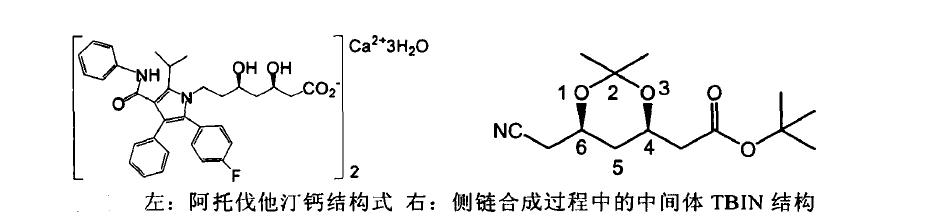
阿托伐他汀钙结构式如上图左所示,其含有两个手性纯的侧链是其关键结构,侧链部分为β,δ-二羟基戊酸结构,该结构是HMG-CoA 还原酶的底物HMG-CoA 的结构类似物,β,δ-二羟基戊酸或其内酯结构是他汀类药物发挥作用的必需基团,两个手性碳上的羟基为顺式构型且β位羟基为R构型是其发挥活性所必需。当前工业生产中合成其侧链中间体(4R,6R)-6-氰甲基-2,2-二甲基-1,3-二氧六环-4-乙酸叔丁酯(TBIN)的方法主要为全化学合成,而近年来逐渐发展为化学酶法组合合成。
合成:
以廉价、易得的消旋环氧氯丙烷为起始原料得到目标产物。具体步骤如下:
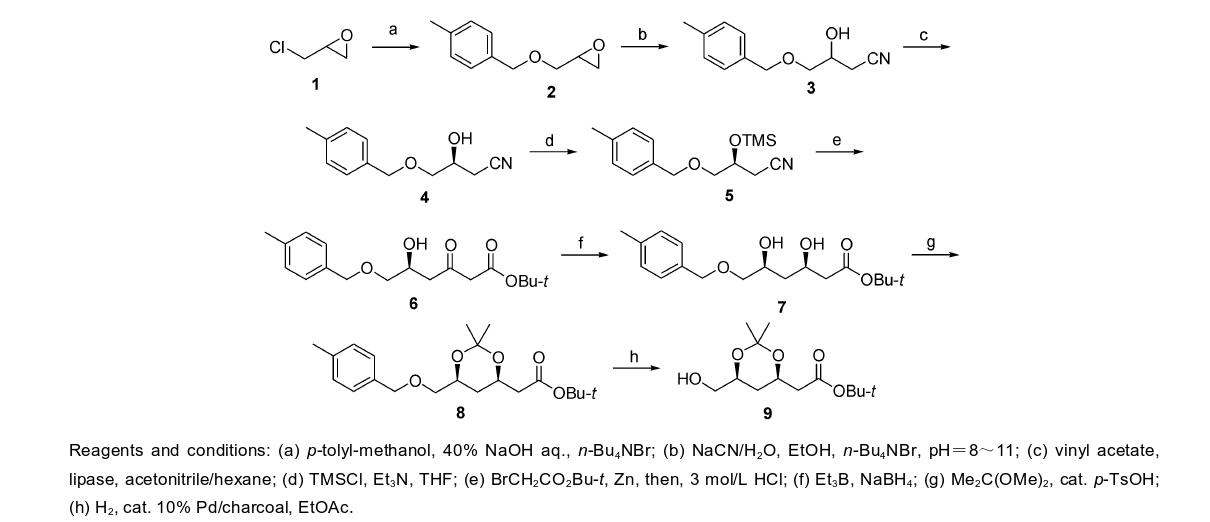
(1)3-对甲基苄氧基-1,2-环氧丙烷(2)的合成
向500 mL的三口烧瓶依次加入61.0 g (0.5 mol)对甲基苯甲醇,40% w/w氢氧化钠水溶液(200 mL),3.0 g (9.4 mmol)四丁基溴化铵,在常温下搅拌10 min。冷却到5 ℃,缓慢滴加92.0 g (1.0 mol)环氧氯丙烷,滴加50 min。反应混合物在5~10 ℃下搅拌24 h。反应结束后,加入二氯甲烷(100 mL×2)萃取。有机层合并,滴加稀盐 酸至酸性,饱和碳酸氢钠中和。有机相分离,无水硫酸 钠干燥,减压蒸馏,b.p. 110~120 ℃ (133 Pa),得到 76.5 g无色液体2,产率86.0%。
(2)4-对甲基苯甲氧基-3-羟基-丁腈(3)的合成
向250 mL的三口烧瓶,加入17.8 g (100 mmol) 3-对甲基苄氧基-1,2-环氧丙烷(2),40 mL无水乙醇,缓慢滴加20.0 g浓度30%的氰化钠溶液和18.5 g浓硫酸,控制pH=8~11,60 min后滴加结束。反应混合物在38 ℃ 下,搅拌10 h。TLC跟踪检测反应结束后,减压蒸去乙醇,然后加入40 mL水和120 mL乙酸乙酯。 有机层分离,无水硫酸钠干燥,减压蒸去溶剂,得到18.5 g油状产物3,产率90%。
(3)(S)-4-对甲基苯甲氧基-3-羟基-丁腈(4)的合成
向混合溶剂[V(正已烷)∶V(乙腈)=4∶1,500 mL] 中,依次加入30.8 g (150 mmol) 3,3.0 g脂肪酶 Artgribacter sp. 和300 mmol乙酸乙烯酯,放入30 ℃摇床,搅拌48 h。酶过滤,用乙酸乙酯清洗两次,滤液减压蒸馏。得到的油状物用硅胶柱分离[V(乙酸乙酯)∶V(正己烷)=1∶4],得到目标产物14.0 g,产率47.0%, ee值98%。
(4)(S)-6-对甲基苄氧基-5-羟基-3-氧代-己酸叔丁酯(6)的合成
向250 mL的三口烧瓶,加入100 mL四氢呋喃,8.2 g (40 mmol) 4,4.5 g (45 mmol)三乙胺控制温度10 ℃以下,滴加4.6 g (42 mmol)三甲基氯硅烷和25 mL四氢呋喃混合液,50 min后滴完。缓慢升至室温,继续搅拌12 h。TLC检测显示反应结束后,滴加40 mL 10%氯化铵溶液中和。加入150 mL乙酸乙酯萃取,有机层分离,干燥,减压蒸去溶剂,得到10.5 g无色油状物3-三甲基硅 氧基-4-对甲基苯甲氧基丁腈(5),产率95%。
常温下,向250 mL的三口烧瓶,加入60 mL四氢呋喃,3.9 g (60 mmol)锌粉,4 mg (0.4 mmol)甲基磺酸,加热回流15 min。缓慢滴加9.0 g (50 mmol)溴乙酸叔丁酯,6.9 g (25 mmol) 5和60 mL四氢呋喃的混合液,1 h后滴 加结束,继续搅拌4 h。TLC检测显示反应结束后,冷却到0 ℃,滴加100 mL 浓度为3 mol/L的HCl,搅拌1 h。加入乙酸乙酯100 mL萃取,饱和碳酸氢钠中和后,有机层分离,无水硫酸钠干燥,减压蒸馏,硅胶柱分离 [V(乙酸乙酯)∶V(正己烷)=1∶4]得到9.8 g无色油状物 6,收率80%。
(5)(3R,5S)-6-对甲基苄氧基-3,5-二羟基己酸叔丁酯(7)的合成
向50.0 mmol Et3B溶液(38 mL,约13% (V/V)THF 溶剂),加入无水THF 60 mL,30 mL HPLC级甲醇。在氮气保护下,室温搅拌1 h。冷却至-70 ℃,滴加底物8.1 g (25 mmol),搅拌40 min,分批加入NaBH4 3.2 g (8.6 mmol)。滴加结束后在-60 ℃搅拌5 h。再加入6%的稀盐酸,调节p H为7,升温至0 ℃。加入乙酸乙酯(100 mL×2)萃取,饱和碳酸氢钠中和后,有机层分离,干燥, 减压浓缩。
向蒸馏后的油状物加入40 mL THF和40 mL水,放置于冰浴中,用稀NaOH水溶液,调节反应液pH=9~11,滴加2 mL 30% H2O2,搅拌40 min。缓慢加入3.0 g NaHSO3至把剩余的H2O2反应完。加入20 mL饱和 NaHCO3水溶液,调节溶液pH=7,有机层分离,干燥,减压蒸除溶剂后,得到约6.6 g粗产物7,收率81.2%,纯度95% (产物7转化为8后的GC纯度)。
(6)(4R,6S)-6-对甲基苄氧基-2,2-二甲基-1,3-二氧 六环-4-乙酸叔丁酯(8)的合成
向100 mL的三口烧瓶中分别加入6.5 g (20 mmol) 7,20 mL 2,2-二甲氧基丙烷,0.3 g对甲苯磺酸,常温下,搅拌4 h。加入饱和5 mL NaHCO3水溶液中和. 加入50 mL乙酸乙酯萃取,有机相分离,无水硫酸钠干燥,减压蒸去溶剂后得到油状物6.9 g,收率95.0%。
(7)(4R,6S)-6-羟甲基-2,2-二甲基-1,3-二氧六环-4- 乙酸叔丁酯(9)的合成
向500 mL的高压釜中分别加入5.7 g (16 mmol) 8,1 g Pd/C (10%),100 mL乙酸乙酯。控制温度32 ℃,搅拌 15 h. 过滤Pd/C,减压蒸去溶剂,得到油状物3.9 g,收率95%。
参考文献:
[1]王仁凤. 年产100吨(4R,6R)-6-氰甲基-2,2-二甲基-1,3-二氧六环-4-乙酸叔丁酯工艺设计[D]. 浙江工业大学, 2014. DOI:10.27463/d.cnki.gzgyu.2014.000024.
[2]孙丰来,吴坚平,徐刚等. 化学酶法合成(4R,6S)-6-羟甲基-2,2-二甲基-1,3-二氧六环-4-乙酸叔丁酯 [J]. 有机化学, 2008, (06): 1102-1106.