丙氯拉嗪,别称为奋乃静,英文名为Prochlorperazine,常温常压下为白色至黄色固体,可溶于氯仿,乙酸乙酯和醇类有机溶剂。丙氯拉嗪是一种吩噻嗪类衍生物,它是一种常用的典型抗精神病药物,该药物在临床上主要用于治疗偏执性精神病、反应性精神病、症状性精神疾病,单纯型及慢性精神分裂症,也用于治疗神经上具有焦虑紧张症状者,亦可用小剂量配合其他药物治疗。

图1 丙氯拉嗪的药品图
丙氯拉嗪主要用于治疗偏执性精神病、反应性精神病、症状性精神疾病,单纯型及慢性精神分裂症,也用于治疗恶心、呕吐、呃逆等症,神经症具有焦虑紧张症状者,亦可用小剂量配合其他药物治疗。此外,该药物也适用于器质性精神病、老年性精神障碍及儿童攻击性行为障碍。
丙氯拉嗪对吩噻嗪类药物过敏者,肝功能不全者,有血液病、骨髓抑制者,青光眼患者,帕金森病及帕金森综合征患者禁用。此外,妊娠期妇女、哺乳期妇女慎用该药物。
丙氯拉嗪与哌替啶合用,可加强本品的镇静或镇痛作用。可增强单胺氧化酶抑制药、三环类抗抑郁药、普萘洛尔和苯妥英的不良反应。该药物与氟西汀、帕罗西汀、舍曲林合用,可出现严重的急性帕金森综合征。它与锂剂合用,可导致衰弱无力、运动障碍、锥体外系反应增强、脑病和脑损伤。丙氯拉嗪可降低苯丙胺、胍乙啶、抗惊厥药和左旋多巴等的药效。该药物与曲马多合用可引起癫痫发作,它也可逆转肾上腺素的作用而引起严重的低血压。本品与单胺氧化酶抑制药或三环类抗抑郁药合用时,两者的抗胆碱作用可相互增强并延长。
[1] 丙氯拉嗪的使用说明书.
氯米帕明是一种常用于治疗抑郁状态、强迫性神经症和恐怖性神经症的药物。
在治疗初期,可能会出现抗胆碱能反应,如多汗、口干、视物模糊、排尿困难和便秘等。
中枢神经系统不良反应包括嗜睡、震颤和眩晕。还可能发生体位性低血压,偶尔出现癫痫发作、心电图异常、骨髓抑制或中毒性肝损害等。

严重心脏病、有心肌梗死发作史、癫痫、青光眼、尿潴留以及对三环类药物过敏的患者不适合使用氯米帕明。
依那普利、费洛克汀、氟伏沙明、帕罗西汀、普罗帕酮、利托那韦、舍曲林、丙戊酸、安泼那韦、奎尼丁等药物可以抑制氯米帕明的代谢,增强其毒性作用。
醋奋乃静、氯丙嗪、氟哌噻吨、氟非那嗪、美索达嗪、五氟利多、奋乃静、奋乃静/阿米替林、哌泊噻嗪、丙丙氯拉嗪、丙嗪、三氟拉嗪与氯米帕明合用时,可能相互影响代谢,增加血浆水平和毒性。
苄普地尔、西沙比得、多菲菜德、格特氟长辛、格雷沙星、卤泛群、依布特利得、莫克罗卡辛、派迷清、索他洛尔、斯帕沙星等药物与氯米帕明合用,可能会导致Q-T间期延长,出现尖端扭转性室性心跳骤停。
与抗组胺药或抗胆碱药合用,药效可能相互增强。
与甲状腺制剂合用,可能互相增效,导致心律失常。
氯米帕明可增强沙美特罗的血管作用,增加心血管兴奋的危险性。
可降低抗凝药的代谢,增加出血的危险。
氯米帕明可抑制磷苯妥英钠、苯妥英钠的代谢,增加苯妥英钠中毒的危险性。
与奈福泮、奥氮平、曲马朵合用,可能导致癫痫发作。
奥昔布宁可诱导氯米帕明的代谢,降低其效果。
巴比妥酸盐可增加氯米帕明的代谢,可能降低其血清浓度,增强不良反应。
与胍乙啶、二甲苄胍、可乐定、胍那决尔合用,后者的抗高血压作用可能会被降低。
与含雌激素的药物合用,可能增加氯米帕明的不良反应,同时降低其抗抑郁作用。
与单胺氧化酶抑制药合用,可能引发高血压危象,甚至导致死亡。
与肾上腺素受体激动药合用,可能引起严重高血压和高热。
氯米帕明可降低癫痫阈值,与抗癫痫药合用时可能降低其抗癫痫作用。
异丙烟肼、异卡波肼、吗氯丙胺、烟肼酰胺、帕吉林、苯乙肼、丙卡巴肼、塞利吉林、托洛沙酮、苯环丙胺与氯米帕明合用,可能导致神经毒性、癫痫发作或5-羟色胺综合征。
2,5-二氯吡嗪,英文名:2,5-Dichloropyrazine,CAS号:19745-07-4,分子量:148.978,密度:1.5±0.1g/cm3,沸点:184.4±35.0°C at 760 mmHg,分子式:C4H2Cl2N2,熔点:52-54℃,闪点:81.5±11.5°C,蒸汽压:1.0±0.3 mmHg at 25°C,为黄色液体,室温下保存。

将2?羟基吡嗪12克加入250毫升N,N?二甲基亚砜中,降温至0?2℃,分批加入二氯海因12 .8克,保温1小时后,加入450毫升水,再加入700毫升醋酸异丙酯萃取,有机相水洗 (300毫升×2),干燥,旋干溶剂后柱层析后得到3.59克黄色粉末2?羟基?5?氯吡嗪。经检测发现:反应体系的HPLC中面积归一法得到2?羟基?5?氯吡嗪占比为22.1%,副产物27.9%,其他杂质36%。
将2?羟基?5?氯吡嗪加入35克三氯氧磷中升温至60℃保温2小时后,倒入100克冰水混合物中,过滤,150毫升醋酸异丙酯萃取、浓缩、蒸馏后得到2.6克淡黄色油状物2,5?二氯吡嗪,纯度为98%,两步总收率约为14.3%,1H?NMR(CDCl3,600MHz):δ8.39(s,2H)[1]。
1、专利CN202110330873.9公开了一种法匹拉韦中间体及法匹拉韦的合成方法,该方法以单一的2,5?二氯吡嗪或者以2,5?二氯吡嗪和2?氯?5?溴吡嗪的混合物为原料化合物1制备得到法匹拉韦中间体3,6?二氯?2?氰基吡嗪,3,6?二氯?2?氰基吡嗪经过芳环氟代反应、水解反应以及氰基水解反应,最终得到法匹拉韦[1]。
2、专利CN202110491895.3介绍了将3-巯基丙酸乙酯缓慢滴加到2,5-二氯吡嗪在碳酸钾的DMF溶液中室温反应4h。监测反应完全后,后处理柱层析分离得化合物B3-1。再与乙醇钠反应,得到5-氯吡嗪-2-硫醇钠(B3),制得实施例5的化合物,为后续开发SHP2磷酸酶抑制剂提供骨架支持[2]。
[1]兰州康寓信生物科技有限公司. 一种法匹拉韦中间体及法匹拉韦的合成方法:CN202110330873.9[P]. 2021-06-29.
[2]中国药科大学. 一种含甲脒的芳基螺环类化合物及其制备方法与应用:CN202110491895.3[P]. 2021-08-13.
近期在《International Journal of Cardiology Hypertension》上发表了一篇论述,指出噻嗪型利尿剂在降压方面的作用微不足道。然而,我们常用的降压利尿剂中就包括噻嗪型利尿剂-氢氯噻嗪,并且它广泛应用于许多单片复方制剂中。与此相比,噻嗪样利尿剂如氯噻酮和吲达帕胺在临床上使用较少。作者认为指南应更加强调噻嗪样利尿剂作为优选的利尿类降压药。
事实上,这一观点已经存在很久,相关文献认为这是因为以下三个主要原因:
一、噻嗪样利尿剂具有更长的半衰期和持续24小时的降压效果。
单次口服后,氢氯噻嗪(HCTZ)在约2小时内达到峰值浓度,半衰期为6.5-9小时。相比之下,氯噻酮(CTD)的半衰期更长,达到42小时(范围为29-55小时)。一项双盲随机试验显示,CTD显著降低了24小时动态血压(白天和夜间一样),而HCTZ并未观察到明显的24小时动态血压降低效果,仅将持续性高血压转化为隐性高血压。
二、噻嗪样利尿剂比噻嗪型利尿剂具有更强的降压作用。
荟萃分析发现,吲达帕胺和氯噻酮在降低收缩压和舒张压方面均优于HCTZ。
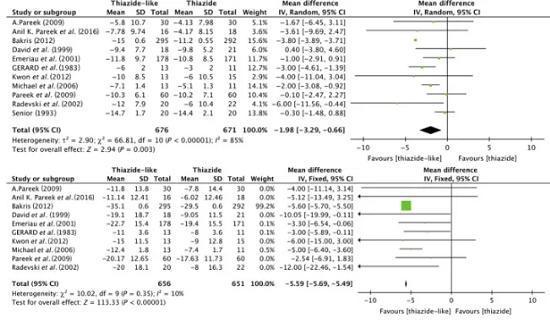
与氢氯噻嗪相比,噻嗪样利尿剂不会显著增加低钾血症和低钠血症的风险,也不会显著改变血糖和血清总胆固醇。
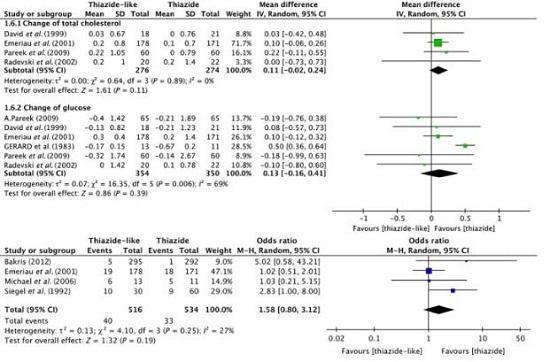
三、噻嗪样利尿剂更能预防心血管事件。
荟萃分析和观察研究比较表明,噻嗪样利尿剂在预防心血管事件方面优于HCTZ,能够降低高血压患者心脏病发作、卒中和充血性心衰的风险。而常规剂量的HCTZ(12.5-25 mg/天)并没有明确证据显示其降低心血管事件的效果。
【译读点评】
噻嗪型利尿剂的基本化学结构由苯丙噻二嗪核和磺酰胺基组成,包括氢氯噻嗪、苄氟噻嗪、氢氟噻嗪、甲氯噻嗪等。而噻嗪样利尿剂虽然也含有磺酰胺基,但其化学结构与噻嗪型不同,同样作用于远曲小管,包括氯噻酮、吲达帕胺和美托拉宗等。尽管荟萃分析显示噻嗪样利尿剂在降压方面优于噻嗪型利尿剂,但目前仍缺乏头对头的RCT研究来明确两者之间在降压疗效、心血管保护和对代谢的不良影响等方面的差异。个人认为就目前常用的降压剂量而言,噻嗪样利尿剂应优于噻嗪型利尿剂。
1.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5661252/#!po=35.8696
2.https://www.sciencedirect.com/science/article/pii/S2590086220300318
过敏是一种普遍存在且不受人群和国界限制的疾病。无论是新生儿还是老年人,在各个年龄阶段都有可能患上过敏性疾病,从湿疹到哮喘、呕吐、腹泻、休克等症状都可能出现。即使是那些以容貌为生的明星们也会遭遇过敏,情况堪称糟糕。
过敏性皮肤病
荨麻疹、湿疹、皮肤红肿瘙痒、红斑等
过敏性鼻炎
阵发性喷嚏、清水样鼻涕、鼻塞和鼻痒,部分伴有嗅觉减退。花粉、螨虫、动物毛屑、食物等均可诱发。
小儿过敏性眼病
眼皮浮肿,眼结膜充血发红,流眼泪,孩子常因眼睛痒痒,而揉眼睛;眼睛出现透明黏稠的分泌物。
多由花粉引起,高发于春夏季节;灰尘、动物毛屑等亦可诱发。
过敏性哮喘
食物、花粉、尘螨、毛屑、刺激性吸入物:甲醛、二氧化硫、氯胺等诱发。

第三代
左西替利嗪在2001年被比利时UCB公司研发成功并进入市场,2004年进入中国。
第二代
氯雷他定/西替利嗪:90年代进入中国。
特非那定/阿司咪唑:80年代进入中国。
第一代
苯海拉明/氯苯那敏/异丙嗪:60年代进入中国市场,氯苯那敏是复方感冒药成分之一。
第三代
左西替利嗪体内代谢极少,几乎不产生嗜睡、头昏等中枢副作用,安全性高。
第二代
氯雷他定/西替利嗪心脏毒性很小,但有嗜唾、乏力、头痛、口干恶心等反应。
特非那定/阿司咪唑可诱发心脏毒性,严重者可发生致死性心律失常,已在许多国家停止使用和生产。
第一代
苯海拉明/氯苯那敏/异丙嗪:对中枢神经的影响较大,不良反应较多。
氯丙嗪这个药你可能很陌生,但是《The BMJ》却把它评为1840年以来,医学领域的15个重大进展之一。氯丙嗪的发现和使用,是精神病治疗史上的里程碑,实现了精神病医学史上的革命,因此有人把氯丙嗪称为精神科的“青霉素”。下面我们看看它是怎么诞生的。

氯丙嗪的发现有很多的偶然因素,其发现过程也颇具传奇色彩。
1950年罗纳·普朗克公司在研究抗组胺类药物时合成了氯丙嗪,原本是希望从中找出抗疟疾药物。因这些产品中有一些具有抗组胺作用,公司将其中一种以“异丙嗪”的药名出售。同年,巴黎的外科医生亨利·拉伯里特(Henri Laborit)得到了异丙嗪,当时他正在探索抗组胺药物能否减轻休克,结果发现,病人应用异丙嗪之后情绪发生了很大变化,显得平静,放松。基于此发现,拉伯里特发表一篇没有数据的临床观察记录,巧合的是,这篇论文被罗纳·普朗克公司看到,公司立即着手将抗组胺药物转向开发作用于中枢神经系统的药物。
1950年12月在异丙嗪的基础上化学家P·卡本提(Paul Charpentier)合成了化合物RP-3277,也就是日后的氯丙嗪。
1952年拉伯里特建议氯丙嗪可以用于精神病的治疗,同年精神病学家让·雷德(Jean Delay)和皮埃尔·德尼尔克(Pierre Deniker)对氯丙嗪做进一步的临床试验,试验结果证明氯丙嗪可以明显减轻精神病患者的幻想和错觉,这一结果报告于第15届法国精神病学和神经病学大会,在医学界引起轰动。
1952年12月,氯丙嗪在法国上市,取名氯普马嗪(Largaotil),意为“有多种作用”。
1954年氯丙嗪获得FDA批准,商品名为索拉嗪。
1964年全世界约5000万人使用了本药。
1972年Paul Greengard实验室首次发现氯丙嗪的作用与多巴胺受体有关,由此掀起了多巴胺研究的热潮。作为治疗精神病的第一种药物,氯丙嗪历史功绩斐然,它的发现改变了精神病患者的预后,并在西方国家掀起了非住院化运动,就拿美国来说,1955年住院的精神病病人是55.9万人,10年后降低到了45.2万人。住院人数减少了近20%,有的精神病医院甚至由于缺少病人而关门了。
在氯丙嗪出现前,人们认为疯了就是疯了,就是废人了。有了氯丙嗪,近75%的急性患者可以重新融入社会,参加工作,正常生活。慢性患者也有相当一部分的病情得到了控制。它开启了药物治疗精神疾病,让病人恢复社会功能的新时代。
自1952年氯丙嗪发现以后,抗精神分裂症药物又经历了两个非常重要的里程碑式时代:1989年获FDA批准上市的氯氮平(非典型抗精神裂症药物)及1993年问世的利培酮(新型非典型抗精神裂症药物)。
2-氯-4,6-二甲氧基-1,3,5-三嗪作为一种重要的中间体,具有广泛的应用价值。本文将探讨2-氯-4,6-二甲氧基-1,3,5-三嗪在化学合成等领域的具体应用。
简述:2-氯-4,6-二甲氧基-1,3,5-三嗪,英文名称:2-Chloro-4,6-dimethoxy-1,3,5-triazine,CAS:3140-73-6,分子式:C5H6ClN3O2,外观与性状:白色至近乎于白色结晶粉末。需存放在阴凉干燥的地方,使用完毕后要将容器密封好,容器要保持严密封闭。
应用:
1. 合成来氟米特
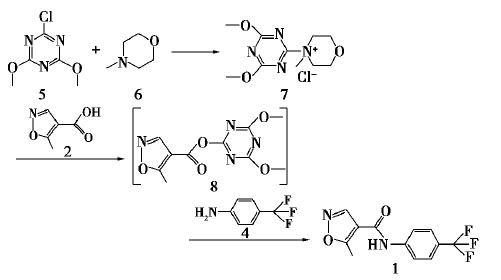
来氟米特(Leflunomide),化学名为5-甲基 N-[4-(三氟甲基)苯基]-4-异唑甲酰胺(5 Methyl-N-[4-(trifluoromethyl)phenyl]-4-isoxazole carboxamide),是德国Hoechest Marion Roussel公司开发的抗风湿药物(DMARDs),1998年首次经 FDA批准在美国上市,商品名Arava,临床用于治疗类风湿关节炎、患者关节疼痛和肿胀,以及关节延迟性损伤等。
2-氯-4,6-二甲氧基-1,3,5-三嗪和N-甲基吗啉反应得到氯化4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉,其与5-甲基异唑-4-甲酸反应制备2-(5-甲基异唑-4-甲酰氧基)-4,6-二甲氧基-1,3,5-三嗪,所得化合物与4-三氟甲基苯胺反应合成来氟米特,总收率约72%(以5-甲基异唑-4-甲酸计)。合成路线如下:
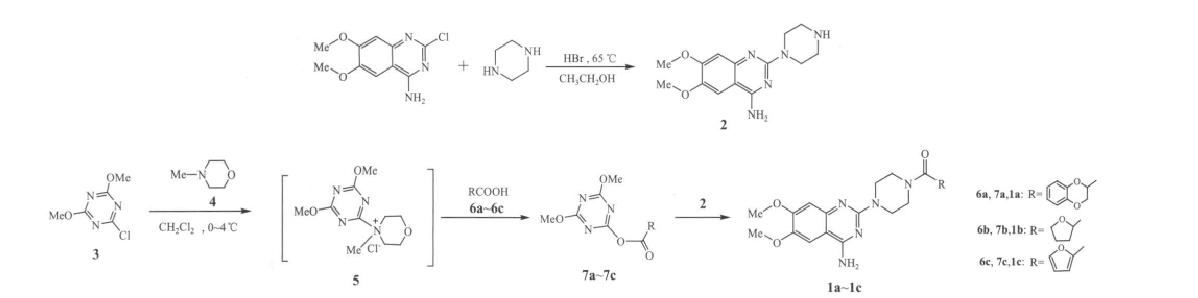
2. 合成多沙唑嗪、特拉唑嗪及哌唑嗪
用4-氨基-2-氯-6,7-二甲氧基喹唑啉与无水哌嗪反应制得4-氨基-2-哌嗪基-6,7-二甲氧基喹唑啉(2)。另用2-氯-4,6-二甲氧基-1,3,5-三嗪(3)和4-甲基吗啉(4)反应后加入相应的羧酸,制得的中间体7再与2反应分别制得多沙 唑嗪(1a)、特拉唑嗪(1b)和哌唑嗪(1c),总收率分别为82.3%、88.0%和86.4%(以3计)。合成路线如下:
3. 合成环丙氨嗪
环丙氨嗪是一种国内外需求量很大的三嗪类杀虫剂,属于1,3,5-三嗪类昆虫生长调节剂;其关键中间体环丙胺是三元环脂肪胺,是重要的医药中间体,广泛用于农药、医药等领域。以γ-丁内酯、氯化亚砜、甲醇钠、液氨、次氯酸钠为原料,经过氯化、酯化、环合、胺化、霍夫曼重排等反应合成了环丙胺,以三聚氯氰和氨水缩合反应制备2-氯-4,6-二氨基-1,3,5-三嗪。然后以环丙胺和2-氯-4,6-二氨基-1,3,5-三嗪为原料可合成目标产物环丙氨嗪,最佳工艺条件为:反应时间5h、氢氧化钠与2-氯-4,6-二氨基-1,3,5-三嗪的摩尔比为1.05∶1、纯化水与2-氯-4,6-二氨基-1,3,5-三嗪质量比6∶l、反应温度100℃,在该条件下进行了放大试验,得到环丙氨嗪粗品的收率达96.16%、纯度≥97.5%。
4. 合成4-取代喹唑啉-7-甲酰胺以及6-取代吡咯并[2,3-d]嘧啶类化合物
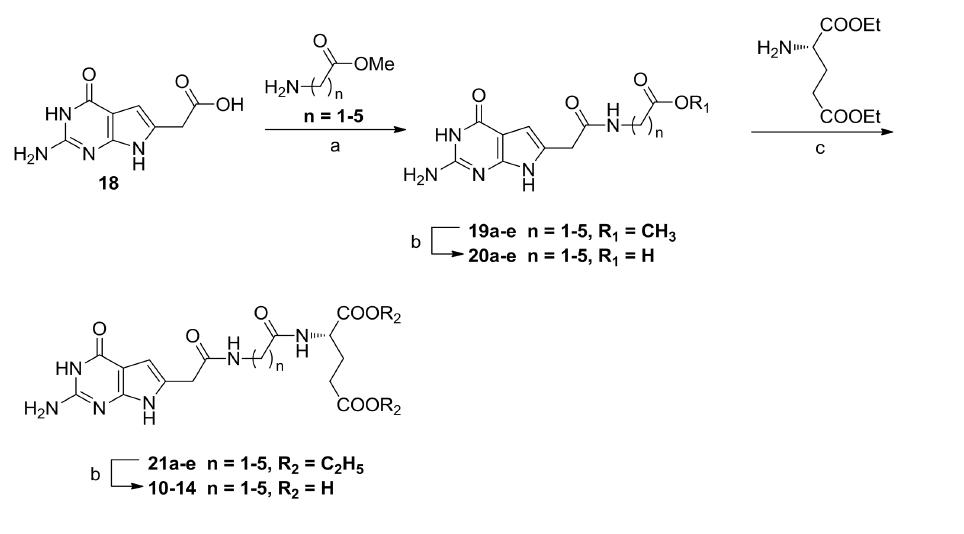
张红英等人以2,6-二氨基-4-氧嘧啶(15)为原料与4-氯乙酰乙酸乙酯(16)合环得到化合物2-(2-氨基-4-氧-3,7-二氢-1H-吡咯并[2,3-d]嘧啶)乙酸乙酯(17)。化合物17经NaOH溶液(1 mol/L)水解、HCl溶液(3 mol/L)酸化得到中间体2-(2-氨基-4-氧-3,7-二氢-1H-吡咯并[2,3-d]嘧啶)乙酸(18)。中间体18经缩合剂1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDCI)、1-羟基苯并三唑(HOBt)活化后与不同的氨基酸甲酯缩合得到中间体19a-e,随后将其水解酸化得到中间体20a-e。中间体20a-e经N-甲基吗啉(NMM)和2-氯-4,6-二甲氧基-1,3,5-三嗪(CDMT)活化,与L-谷氨酸二乙酯盐酸盐缩合得到中间体21a-e。中间体21a-e水解酸化得到目标化合物。
参考文献:
[1] 陈林,杨晴来,王宏飞,等. 多沙唑嗪、特拉唑嗪及哌唑嗪的高效合成[J]. 中国医药工业杂志,2013,44(2):128-130.
[2] 杨同江,王全亮,单衍强,等. 活性酯法合成来氟米特[J]. 化学试剂,2011,33(10):948-950. DOI:10.3969/j.issn.0258-3283.2011.10.025.
[3] 张华刚. 三嗪类杀虫剂环丙氨嗪及其关键中间体的制备研究[D]. 河南:郑州大学,2019.
[4] 张红英. 4-取代喹唑啉-7-甲酰胺以及6-取代吡咯并[2,3-d]嘧啶类化合物的设计、合成及生物活性研究[D]. 河北:河北医科大学,2017.
引言:
本文将深入探讨多非利特的副作用,帮助人们了解这种药物可能带来的潜在风险。尽管多非利特在管理某些心律失常方面具有有效性,但深入探索多非利特的负面影响,理解其副作用的全貌至关重要。通过全面了解多非利特的潜在副作用,个人可以在治疗方面做出明智的决定,并减轻与其使用相关的风险。
1. 什么是多非利特?
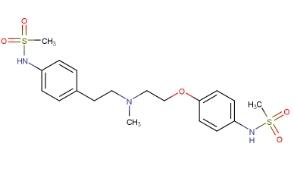
多非利特是一种具有III类(心脏动作电位持续时间延长)特性的抗心律失常药物,用于维持正常的窦性心律。多非利特以可预测的、浓度依赖的方式增加单相动作电位持续时间,主要是由于延迟复极。在覆盖几个数量级的浓度下,多非利特只阻断IKr,而没有相关的阻断其他重极化钾电流(例如ikk, IK1)。在临床相关浓度下,多非利特对钠通道(与I类相关)没有影响。多非利特的结构如下:
2. 多非利特作用机制
多非利特通过选择性阻断延迟整流外向钾电流(IKr)的快速成分发挥作用。这导致心房组织的不应期增加,因此其治疗心房颤动和心房扑动的有效性。
多非利特不影响dV/dTmax(第0相去极化上升支斜率)、传导速度和静息膜电位。
QT间期和校正QT间期(QTc)有剂量依赖性增加。因此,许多从业人员只会在接受遥测监测或者可以对QT和QTc进行连续心电图测量的患者中开始多非利特治疗。
3. 多非利特有哪些副作用?
(1)>10%
头痛 (11%)
(2)1-10%
胸痛 (10%)
头晕 (8%)
失眠 (4%)
呼吸道感染 (7%)
呼吸困难 (6%)
皮疹 (3%)
流感样综合征 (4%)
背痛 (3%)
室性心动过速 (3-4%)
尖端扭转型室性心动过速(心衰患者为 3%,近期心肌梗死患者为 0.9%)
恶心 (5%)
腹泻 (3%)
(3)频率未定义
房室传导阻滞、QTc 间期延长、尖端扭转型室性心动过速、室性心律失常
睡眠困难
肝损伤
咳嗽
感觉异常
血管性水肿
这不是副作用的完整列表,可能会发生其他副作用。致电您的医生以获取有关副作用的医疗建议。
4. 多非利特的严重副作用
尖端扭转型室性心动过速是多非利特治疗最严重的副作用。尖端扭转型室性心动过速的发生率为 0.3-10.5%,与剂量相关,剂量越高,发生率增加。大多数尖端扭转型室性心动过速发作发生在初始给药的前三天内。患者应在开始使用多非利特后的前三天住院并接受监测。
在开始治疗时采取预防措施,例如让患者住院至少三天进行连续肌酐测量、连续遥测和心脏复苏,可以降低诱发尖端扭转型室性心动过速的风险。
5. 多非利特相互作用
约80%的单剂量多非利特通过尿液排泄,其中约80%以未改变的多非利特形式排泄,其余20%由无活性或最低活性代谢物组成。肾脏消除包括肾小球滤过和肾小管活性分泌(通过阳离子转运系统,这一过程可被西咪替丁、甲氧苄啶、丙氯拉嗪、甲地孕酮、酮康唑和多替拉韦抑制)。对人肝微粒体的体外研究表明,CYP3A4可以代谢多非利特,但它对这种同工酶的亲和力很低。已知以下药物列表通过抑制肾脏消除与多非利特具有显着的相互作用:
西咪替丁
维拉帕米
酮康唑
甲氧苄啶单独使用或与磺胺甲噁唑联合使用
丙氯拉嗪
甲地孕酮
多替拉韦
氢氯噻嗪单独使用或与其他药物联合使用
使用本药时不要吃葡萄柚或喝葡萄柚汁。葡萄柚和葡萄柚汁可能会改变这种药物在体内吸收的量。
除非与您的医生讨论过,否则不要服用其他药物。这尤其包括钾补充剂或含钾的盐替代品,或某些利尿剂(如阿米洛利、螺内酯、氨苯蝶啶)。
其他药物可能与多非利特相互作用,包括处方药和非处方药、维生素和草药产品。告诉每位医务人员您现在使用的所有药物以及您开始或停止使用的任何药物。
6. 长期服用多非利特有什么作用——风险和注意事项
多非利特是一种长期用于维持正常心律(窦性心律)和防止心房颤动或心房扑动等不规则心跳再次出现的药物。在你服用多非利特的过程中,医生会密切监测你的情况,因为这种药物有可能引起一种叫做尖端扭转型室性心动过速的严重副作用,这是一种异常的心跳。以下是关于长期使用多非利特需要考虑的其他几点:
(1)多非利特需要服用多长时间取决于您的个人情况和药物对您的疗效。
(2)你的医生可能需要定期做血液检查,检查你的电解质和肾功能,因为这些会影响多非利特在你体内的工作。
(3)告诉你的医生你正在服用的所有其他药物是很重要的,包括非处方药和补充剂,因为一些药物会与多非利特发生相互作用。
如果您对长期服用多非利特有任何疑问或担忧,请务必咨询您的医生。
7. 多非利特的常见问题解答
(1)多非利特是高危药物吗?
由于多非利特的潜在副作用,尤其是称为尖端扭转型室性心动过速的不规则心跳,因此可能是一种高危药物。这就是为什么它通常是在医院进行监测。
(2)多非利特会引起焦虑吗?
焦虑不是多非利特常见的副作用。然而,头晕,一个列明的副作用,有时会被误认为焦虑。如果服用多非利特期间出现焦虑,请咨询医生。
(3)多非利特会产生胀气吗?
肠胃胀气是多非利特较少见的副作用。
(4)多非利特会导致肝损伤吗?
暂不清楚,但肝损伤不是多非利特报告的副作用。
(5)胺碘酮和多非利特哪个更好?
这取决于个人情况。胺碘酮和多非利特都是治疗心律不齐的有效药物,但它们的副作用和作用方式不同。医生会根据具体需求和病史来决定哪种药物最适合。
8. 结论
总的来说,多非利特作为一种抗心律失常药物,虽然在治疗心房纤颤和心房扑动等心律失常疾病中具有显著的疗效,但也存在一些潜在的副作用和风险。一些常见的多非利特副作用包括心律失常加重、头晕、乏力等,严重的副作用可能包括心脏停跳或心脏骤停等。在使用多非利特时,患者应密切注意身体反应,并及时向医生报告任何不适症状。如果出现严重副作用或不良反应,应立即就医并寻求专业医生的建议和指导。在治疗心律失常时,与医疗专家密切合作是至关重要的。如果您有任何关于多非利特副作用的疑问或需要进一步了解,请务必咨询您的医生。
参考:
[1]https://www.cigna.com/knowledge-center/hw/medications/dofetilide-d04459a1
[2]https://labeling.pfizer.com/
[3]https://www.ncbi.nlm.nih.gov/books/NBK459154/
[4]https://go.drugbank.com/drugs/DB00204
[5]https://reference.medscape.com/drug/tikosyn-dofetilide-342298
异丙胺,也被称为IPA或MIPA,是一种无色吸湿性液体,具有氨味并可燃。它广泛应用于农药生产,例如作为甲基异硫磷、噻嗪酮和阿特拉津等重要中间体。此外,它还在精细化工行业中被广泛用于生产洗涤剂、橡胶和医药等产品。
异丙胺可以与醛发生缩合反应,例如与苯甲醛反应生成N-亚苄基异丙胺。它还可以与酰氯反应,例如与联苯-4,4'-二甲酰氯在三乙胺存在下反应生成N,N'-二异丙基联苯-4,4'-二甲酰胺。
异丙胺是一种碱,可以与酸发生反应,例如:
C3H9N + HNO3 → [C3H9NH]NO3
C3H9N + HCOOH → [C3H9NH]HCOO
异丙胺的合成方法具有以下特征:在固定床反应器之前设置预热器,并在固定床反应器之后设置气液分离器。固定床反应器的进料端和出料端均用石英砂装填,中间段装填混合催化剂。合成异丙胺的原料包括丙酮、氢气和氨气,通过丙酮还原氨化合成异丙胺。反应条件为:反应压力为常压~0.4MPa,反应温度为80~130°C,丙酮、氢气、氨气的摩尔比为1:3:4~4.6,丙酮液体空速为0.1~0.5111。
混合催化剂由镍基催化剂与石英砂按2:0.8~1.2的质量比均匀混合而得。石英砂经过钝化处理后,用于装填固定床反应器的进料端和出料端。钝化处理方法为:将40~60目的石英砂在800°C焙烧24小时,然后冷却至室温。
西替利嗪是一种重要的药物,其合成方法对于药物研究和开发具有重要意义
简述:西替利嗪是第二代H1抗组胺药,为长效过敏性鼻炎、过敏性皮肤瘙痒、结膜炎等。西替利嗪与其同类药如海拉明、异丙嗪、扑尔敏相比,西替利嗪具有良好的抗过敏作用,副反应少且可耐受。
合成:
1. 方法一
有文献报道1-[(4-氯苯基) 苯甲基]哌嗪(Ⅱ)与氯乙氧基乙酰胺反应合成盐酸西替利嗪。0.15mol(Ⅱ),0.2 mol氯乙氧基乙酰胺,26.5 g无水碳酸钠在120 mL二甲苯中, 于90℃~120℃反应4 h,经提纯得2-[2-[4-[(4-氯 苯基)苯甲基]-1-哌嗪基]乙氧基]乙酰胺,收率47%。但文献未直接提到2-[2-[4-[(4-氯苯基)苯甲基]-1- 哌嗪基]乙氧基]乙酰胺水解、酸化合成盐酸西替利的方法,但相似结构2-[2-[(4-二苯基甲基)-1-哌嗪基]乙氧基]乙酰胺在氢氧化钠的乙醇溶液中回流 水解3 h,酸化得盐酸西替利嗪(Ⅰ),收率为91%。
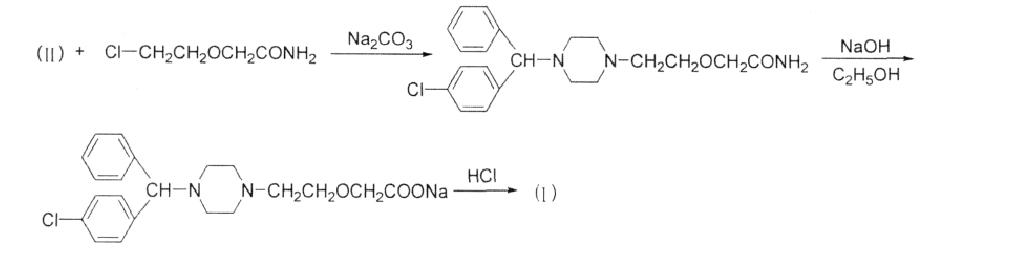
2. 方法二
0.3 mol1-[(4-氯苯基) 苯甲基]哌嗪(Ⅱ)、0.38 mol氯乙氧基乙酸甲酯和0.38 mol 碳酸钠在500 mL无水二甲苯中回流反应40 h。反应物过滤,滤液浓缩除去溶剂,残留物过柱得中间体 2-[2-[4-[(4-氯苯基)苯甲基]-1-哌嗪基]乙氧基]乙酸甲酯,收率27.8%。将此中间体在1 mol/L的氢氧化 钾乙醇溶液中回流水解4 h,经提纯得2-[2-[4-[(4- 氯苯基)苯甲基]-1-哌嗪基]乙氧基]乙酸钾盐,收率 56%。再经酸化得西替利嗪,收率81%。
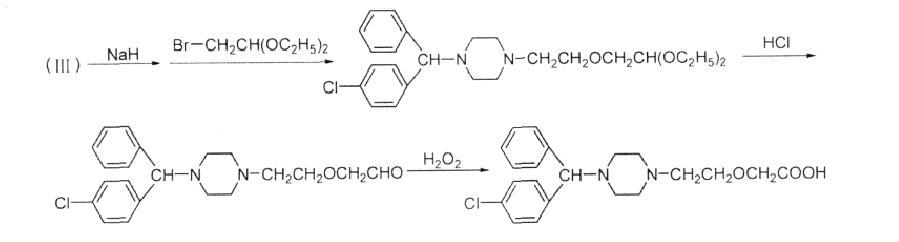
3. 方法三
0.154 mol 2-[2-[(4-氯苯基)苯甲基]- 1-哌嗪基]乙醇(Ⅲ)加入到无水四氢呋喃中,通氮气,加入氢化钠0.2 mol,升温至50℃,搅拌反应20 min, 加入溴乙醛缩二乙醇0.18 mol,升温至90℃,反应5 h,另加入0.033 mol氢化钠和0.015 mol溴乙醛缩二乙醇继续反应5 h,反应体系经分离提纯得2- [2-[4-[(4-氯苯基)苯甲基]-1-哌嗪基]乙氧基]乙醛缩二乙醇,收率96.7%。将此中间体0.0413 mol,浓盐酸 8.3 mL,加入到20 mL水中,在60℃反应30 min, 冷却至室温,加入乙醇20 mL,用氢氧化钠溶液调pH至7,冷却至20℃,加入双氧水0.041 mol,控制pH在6左右,室温搅拌反应至终点(由HPLC 检测),反应体系经分离提纯得西替利嗪,收率为 85.3%。
参考文献:
[1]刘浩,徐勇,覃广德. 盐酸西替利嗪的合成工艺综述 [J]. 浙江化工, 2011, 42 (04): 6-11.
[2]马满玲, 西替利嗪透皮给药控释制剂. 黑龙江省, 哈尔滨医科大学附属第一医院, 2005-01-01.