吲唑-3-羧酸是一种有机化合物,是有机合成中间体和医药中间体,可用于实验室研发过程和化工医药研发过程中,主要用作农药、医药的合成原料以及原料药格拉司琼中间体。以下是关于吲唑-3-羧酸的性质、用途、制法和安全信息的介绍。
吲唑-3-羧酸是一种白色结晶固体,可溶于水和常见有机溶剂。它具有较高的热稳定性和化学稳定性。
吲唑-3-羧酸在有机合成中具有广泛的应用。它是合成吲唑化合物和荧光染料的重要原料。
吲唑-3-羧酸的制备方法较多,常见的方法包括吲唑的氧化和吲唑的羰基化反应。
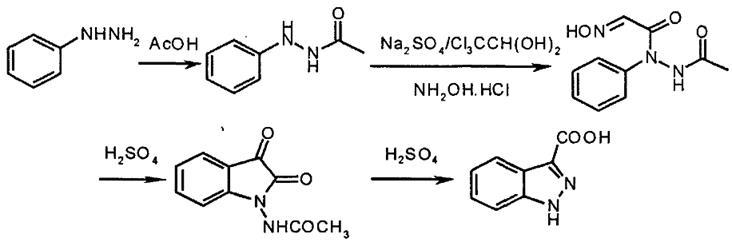
图1 吲唑-3-羧酸的合成反应式
在250mL的三颈瓶中加入N-乙酰苯肼、无水硫酸钠和盐酸水溶液,加热搅拌至85℃。将水合氯醛用水溶解后快速滴加至反应液中,5min后.加入盐酸羟胺,在90℃左右反应20min。冷却至室温后放置到冰箱中冷却析晶得淡黄色固体。抽滤,干燥得粗品,将粗品用丙酮洗涤后得精制N-乙酰氮基异亚硝基乙酰苯胺。
在100mL的三颈瓶中加入20mL的浓硫酸,加热控制温度在55~60℃,分批加入N-乙酰氨基异亚硝基乙酰苯胺,加完后缓慢升温到85℃,搅拌反应15min。冷却至室温。将碎冰加入冷却后的反应液中。搅拌至悬浮液,加热回流2h。然后冷却至温,过滤、水洗得黄色固体。干燥后用冰醋酸反复结晶得淡黄色固体吲唑-3-羧酸。
吲唑-3-羧酸在常规操作下具有低毒性。但作为一种化学品,仍需注意一些安全事项。接触吲唑-3-羧酸应避免直接接触皮肤和眼睛,并应采取良好的通风措施。操作时应穿戴适当的防护设备,如实验手套、护目镜和防护服等。
[1]李光毅. 1H-吲唑-3-羧酸的合成工艺研究[J]. 海峡药学,2010,22(5):226-227. DOI:10.3969/j.issn.1006-3765.2010.05.119.
吲唑作为吲哚的生物电子等排体,备受药物研究者的关注。在合成吲唑衍生物时,常在3-位引入适当的功能基,最常见的是引入羧基官能团,从而形成吲唑-3-羧酸,成为引入吲唑基的重要中间体。
吲唑-3-羧酸及其衍生物具有多种生物活性,如抗精子生成、抗关节炎及镇吐等。吲唑-3-羧酸还是一种高度选择性的5-HT3受体拮抗剂,已广泛用于预防和治疗肿瘤病人因化疗引起的恶心呕吐。近年来,吲唑-3-羧酸作为一种重要的化工产品,受到越来越多的关注。
将靛红的碱性溶液与亚硝酸钠溶液混合,在冷却下加至稀硫酸溶液中进行重氮化,所得重氮盐溶液用二氧化硫饱和再加氯化亚锡还原即可得吲唑-3-羧酸。通过冰醋酸反复重结晶可以精制产物,但其中含有难以除去的含锡杂质。这种方法具有原料易得、操作简单、反应时间短的优点。
吲唑与无水碳酸钾共同研磨置于高压釜中,充入二氧化碳,在260℃旋转加热3小时,最终得到纯品的吲唑-3-羧酸。这种方法简单,反应时间较短,但需要使用高压设备。

图1 吲唑-3-羧酸的合成反应式
吲唑-3-羧酸作为一种重要的医药中间体,其合成方法及药理活性研究受到越来越多的关注。目前已有多种合成方法,但这些方法仍存在不足之处,需要进一步研究和改进。
[1] WO2005/111038 A2, 2005 ;
吲唑及其衍生物具有多种生物学活性,如抗炎、抗肿瘤、抗氧化、降血糖、抗HIV、抗结核、抗血小板、5-HT3受体拮抗作用等。此外,吲唑衍生物还广泛应用于除草剂、染料等。吲唑是一种含有唑环和苯环的化合物,属于唑类家族,具有芳香杂环的特点。5-溴-1H-吲唑-3-羧酸甲酯是一种重要的医药中间体,用于构建活性药物分子母核。它可以通过与吲唑氮、羧基、溴原子等位点进行反应合成得到一系列衍生化合物。
吲唑类化合物的合成方法有多种,但产率低,后处理复杂,不适用于大量生产。5-溴-1H-吲唑-3-羧酸甲酯作为基础原料,价格便宜易得,且能够进一步合成有价值的药物中间体。本文以1H-吲唑-3-甲酸为原料,通过溴代反应在吲唑的苯环5位引入溴原子,合成5-溴-1H-吲唑-3-羧酸甲酯。

图1 5-溴-1H-吲唑-3-羧酸甲酯合成反应式
1H-吲唑-3-甲酸用无水乙酸溶于三颈烧瓶,加热搅拌,底物溶解澄清后,将液溴溶于无水乙酸,缓慢滴加;在油浴锅90℃情况下,冷凝回流反应14小时。待反应完全后,产生白色沉淀,冰浴冷却,真空抽滤,先用乙酸乙酯洗涤固体,后用乙醚洗涤;得到5-溴-1H-吲唑-3-羧酸甲酯。
[1]王燕,黄海洪,饶尔昌,等.1H-吲唑-3-羧酸的合成[J].合成化学,2005,13,(1):16-21
5-氟吲唑-3-羧酸是一种医药中间体,可用于制备选择性雄激素受体降解剂(SARD),从而治疗前列腺癌。这种化合物可以通过一步反应从5-氟吲哚醌合成。
制备过程如下:在氢氧化钠的水溶液中加热5-氟吲哚醌,然后冷却并加入亚硝酸钠。接着在低温下滴入浓硫酸溶液和氯化锡(II)·二水合物的盐酸溶液。反应液经过搅拌和过滤后,得到5-氟-1H-吲唑-3-甲酸。
应用方面,5-氟吲唑-3-羧酸可用于制备具有双重降解和AR-SV抑制功能的选择性雄激素受体降解剂(SARD)。这些化合物能够抑制依赖于AR-FL和AR-SV的前列腺癌细胞和肿瘤的生长。SARD具有成为治疗不可通过其他拮抗剂治疗的CRPC的新治疗剂的潜能,对于前列腺癌的治疗具有重要意义。
前列腺癌是美国男性中最常见的非皮肤癌症之一,每年有超过200,000个新病例和超过30,000例死亡。目前,CRPC的治疗剂市场正以15-20%的年速率增长。然而,当前证据表明CRPC的生长依赖于不具有LBD的AR-SV,如AR-V7,无法通过常规拮抗剂进行抑制。因此,结合AR抑制和降解的策略为管理CRPC提供了替代方案。
[1] [中国发明,中国发明授权] CN200880020245.3 吗啉衍生物
[2] [中国发明] CN201980078969.1 单酰基甘油脂肪酶调节剂
肼二盐酸盐是一种常用的医药合成中间体。
制备(3-甲氧基苄基)肼二盐酸盐的方法如下:在乙醇溶液中加热回流肼·1水合物和3-甲氧苄基氯的乙醇溶液,经过层析和蒸馏,得到目的化合物。
(3-甲氧基苄基)肼二盐酸盐可用于合成4,5-二氢-1-(3-甲氧基甲氧苄基)-7-(5-嘧啶基甲氧基)-[1H]-苯并[g]吲唑-3-羧酸甲酯等医药品。
[1] CN1262681 4,5-dihydro-[1H]-benz [g] indazole-3-carboxylic acid derivatives
盐酸格拉司琼是一种5-HT3受体拮抗剂,具有预防和治疗因放疗、化疗及手术引起的恶心和呕吐的作用。它的化学名为1-甲基-N-(内向-9-甲基-9-氮杂双环[3.3.1]壬烷-3-基)-1H-吲唑-3-甲酰胺盐。格拉司琼由Smith-KlineBeecham公司研制,并于1991年在南非上市。

盐酸格拉司琼的合成方法有多种报道,其中一种新的合成方法使用高托品烷胺盐代替高托品烷胺,排除了高托品烷胺久置后产生的杂质对反应的影响。这种方法包括将1-甲基吲唑-3-羧酸加入非质子溶剂中,降温并在搅拌下滴加酰化剂,加入催化量的N,N-二甲基甲酰胺,反应3~5小时得到1-甲基吲唑-3-甲酰氯;蒸干后溶于非质子溶剂中,加入缚酸剂和高托品烷胺盐酸盐,与酰氯化后产物反应2~28小时,经过后处理得到盐酸格拉司琼粗品,再经过重结晶得到盐酸格拉司琼精制品。
实验室合成过程如下:将3000ml二氯甲烷、71.1g1-甲基吲唑-3-羧酸、34.6ml草酰氯加入5000ml三口瓶中,搅拌。滴加入7.1mlN,N-二甲基甲酰胺,搅拌反应4小时。蒸掉二氯甲烷,重新加入3000ml二氯甲烷溶解,加入130g高托品烷胺盐酸盐、180ml三乙胺,搅拌至次日。溶液为黄色透明。停止搅拌,用饱和碳酸氢钠液洗涤三次。加入无水碳酸钾,搅拌干燥。过滤,常压回收二氯甲烷后,减压蒸尽溶剂,加入1000ml无水乙醇,用氯化氢的乙醇溶液调PH值至2~3。加入晶种结晶。过滤,得粗品。用水和乙醇重结晶,得到最终产物110.7克。收率:87.7%。熔点:290.2~291.1℃。
CN101475569B 用高托品烷胺盐制备盐酸格拉司琼的方法
1-甲基-3-吲唑甲酸是一种广泛应用于精细化工产品、食品、医药和化妆品的防腐剂。此外,它还用于制备染料、杀菌剂、彩色电影胶片和油溶性成色剂等。
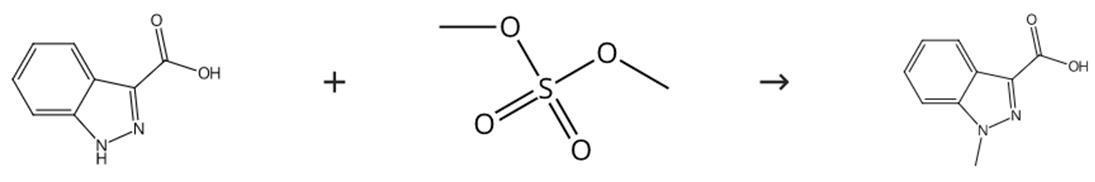
图1 1-甲基-3-吲唑甲酸的合成路线
在甲醇钙存在下,通过ICA与硫酸二甲酯在甲醇中的反应制备1-MICA。首先将甲醇钙(13.0g,0.124mole,2摩尔当量)加入到工业甲醇(150ml)中,并将混合物加热回流2小时,然后加入吲唑-3-羧酸(10g,0.062摩尔)并将混合物加热回流2小时。在回流下滴加硫酸二甲酯(15.6g,11.8ml,0.124摩尔,2摩尔当量)2小时,并继续回流1小时。将混合物在室温下保持过夜。向反应混合物中加入水(100ml)和46%氢氧化钠水溶液,然后加入盐酸以产生约4的pH。通过过滤收集硫酸钙,并用热甲醇洗涤。在减压下除去甲醇,然后加入盐酸以产生约1的pH,并剧烈搅拌混合物2小时。通过过滤收集固体产物,用盐酸洗涤,并在50°C烘箱中干燥过夜,得到1-甲基-3-吲唑甲酸(11.5 g,87.7%产率,HPLC纯度:99.19%)。
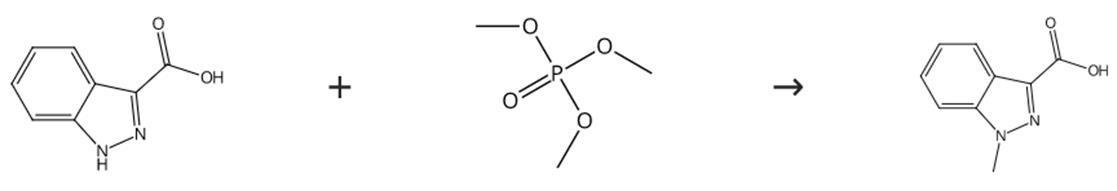
图2 1-甲基-3-吲唑甲酸的合成路线
在乙醇镁存在下,通过ICA与磷酸三甲酯在1-丙醇中的反应制备1-MICA。首先将乙醇镁(14.10g,0.124摩尔,2摩尔当量)加入到工业1-丙醇(100ml)中,然后加入吲唑-3-羧酸(10g,0.0617摩尔)并继续回流2小时。在回流下滴加磷酸三甲乙酯(14:7克,12.3毫升,0.105摩尔,1.7摩尔当量)2小时,并继续回流5小时。将混合物在室温下保持过夜。向反应混合物中加入水(100ml)和46%氢氧化钠水溶液,然后加入盐酸以产生约4的pH。通过过滤收集固体产物,用水洗涤,并在50℃的烘箱中干燥过夜,得到粗1-MICA(10.1g,93.0%产率,HPLC纯度:99.24%)。将粗1-MICA(10.1g)在甲醇-水混合物中用浆料处理,加热回流4小时。通过过滤收集固体产物,用甲醇-水混合物洗涤,并在50°C的烘箱中干燥,获得纯1-甲基-3-吲唑甲酸(8.5 g,78.3%产率,HPLC纯度:99.78%)。
[1]何明. 吲唑甲酸类化合物设计及合成[D].青岛科技大学,2019.
[2]Naddaka, Vladimir; et al. Process for preparing 1-methylindazole-3-carboxylic acid, an intermediate for the drug granisetron, by methylation of indazole-3-carboxylic acid using alkaline earth metal oxides and alkoxides as bases. European Patent Organization, EP1484321 A1 2004-12-08.
吲唑及其衍生物具有多种生物学活性,如抗炎、抗肿瘤、抗氧化、降血糖、抗HIV、抗结核、抗血小板、5-HT3受体拮抗作用等。此外,吲唑衍生物还广泛应用于除草剂、染料等。吲唑是一种含10电子的芳香杂环,只含有碳、氢、氧3种元素。
吲唑类化合物的合成方法有多种,其中以邻卤苯羰基类化合物为原料生成苯肼(或苯腙)然后分子内环化、邻甲基苯胺类化合物的重氮化反应、靛红的重氮化反应以及吲哚的重氮化反应等。然而,以上合成方法的产率较低,后处理复杂,不适用于吲唑的大量生产。
本文介绍了一种简单的制备6-溴-1H-吲唑-4-甲酸的方法。该方法以1H-吲唑-4-甲酸为原料,在室温下通过溴代反应在吲唑的苯环6位引入溴原子,合成6-溴-1H-吲唑-4-甲酸。

图1 6-溴-1H-吲唑-4-甲酸合成反应式
具体操作步骤如下:
[1]王燕,黄海洪,饶尔昌,等.1H-吲唑-3-羧酸的合成[J].合成化学,2005,13,(1):16-21
引言:
氯尼达明(Lonidamine)作为一种药物,其作用机制主要涉及调控细胞能量代谢和凋亡途径。对于氯尼达明的作用机制的深入理解,有助于进一步开发其在肿瘤治疗中的应用潜力。
简介:什么是氯尼达明?
氯尼达明(Lonidamine,LND)是一种干扰癌细胞能量代谢的药物,主要通过影响线粒体结合己糖激酶(HK)来抑制有氧糖酵解活性。在这种情况下,LND可能损害需要能量的过程,如从放射治疗和某些细胞毒性药物引起的潜在致命损伤中恢复。
LND是吲唑-3-羧酸的衍生物,已知在肿瘤细胞中选择性地抑制有氧糖酵解和能量代谢。LND 还可以抑制呼吸复合物 II 的琥珀酸-泛醌还原酶活性,导致活性氧 (ROS) 的形成增强。
1. 氯尼达明的性质
氯尼达明,英文名:Lonidamine,英文简称:LND,化学名:1-(2,4-二氯苄基)-1H-吲唑-3-羧酸,英文名:1-[(2,4-dichlorophenyl)methyl]-1H-indazole-3-carboxylicacid,分子式:C15H10Cl2N2O2,分子量:321.16,熔点:207℃~209℃,CAS号:50264-69-2,白色或类白色粉末。
2. 氯尼达明机制
(1)抗肿瘤作用机制
氯尼达明 (LND) 最初是作为一种抗精子生成剂引入的。后来发现它具有抗癌活性,可使肿瘤对化疗、放疗、光动力疗法和高温疗法敏感。尽管其作用机制尚不清楚,但已知 LND 治疗可以靶向癌细胞中的代谢途径。据报道,它通过抑制糖酵解和线粒体呼吸来改变肿瘤细胞的生物能学,而间接证据表明,它还抑制了由质子连接单羧酸转运体 (MCT) 家族成员介导的细胞 L-乳酸流出,以及线粒体丙酮酸载体 (MPC) 将丙酮酸吸收到线粒体中。最近的研究表明,LND 可有效抑制大鼠肝线粒体分离物中的 MPC 活性(Ki2.5 μM),并协同抑制非洲爪蟾卵母细胞中表达的 MCT1、MCT2 和 MCT4 的 L-乳酸转运,K值为0.5,希尔系数分别为 36–40 μM 和 1.65–1.85。在大鼠心脏线粒体中,LND 以类似的效力抑制 MPC,并且对丙酮酸的非偶联氧化的抑制效果比对谷氨酸等其他底物( IC 50 ~20 μM)更有效(IC 50 ~7 μM)。LND 抑制呼吸复合物 II 的琥珀酸-泛醌还原酶活性,但不完全阻断琥珀酸脱氢酶活性。 LND 还通过复合物 II 诱导细胞活性氧,据报道,它通过抑制戊糖磷酸途径促进细胞死亡,从而抑制 NADPH 和谷胱甘肽生成。MPC 抑制是 LND 最敏感的抗肿瘤靶点,同时对 MCT 介导的 L-乳酸流出、复合物 II 和谷氨酰胺/谷氨酸氧化也有额外的抑制作用。
(2)抑制糖酵解
氯尼达明最初被开发用于癌症治疗,已被证明可以阻止相对缺氧的肿瘤细胞所依赖的糖酵解。氯尼达明如何抑制糖酵解?氯尼达明是一种口服小分子,通过灭活己糖激酶来抑制糖酵解。己糖激酶是一种催化葡萄糖的酶,葡萄糖是糖酵解的第一步(如下图所示)。氯尼达明对己糖激酶的抑制作用已得到充分证实。此外,有证据表明氯尼达明可能会增加程序性细胞死亡。这源于以下观察:线粒体和线粒体结合的己糖激酶对于诱导细胞凋亡至关重要;因此,直接影响线粒体的药物可能会引发细胞凋亡。事实上,氯尼达明的体外模型表现出细胞凋亡的特征,包括线粒体膜去极化、细胞色素 C 释放、磷脂酰丝氨酸外化和 DNA 碎片化。


3. 氯尼达明临床试验
氯尼达明(LND) 已与标准化疗药物联合用于多种癌症的临床试验。LND之前在针对肺癌的II期和III期试验中进行了评估,并被证明是安全的,但疗效有限。
(1)报道一
在一项 II 期研究中,32 名既往接受过治疗的晚期乳腺癌患者接受了氯尼达明的每日分次口服剂量为 600 毫克。在 28 名可评估反应的患者中,3 例 (11%) 达到部分缓解(4-24+ 个月),3 例 (11%) 获得轻微缓解。2 名患者病情稳定(超过 3 个月),20 名患者病情进展。毒性非常轻微。31 例患者中有 16 例 (53%) 有肌痛,中位持续时间为 2 周。通过核磁共振波谱对四名患者进行了研究,但这些变化与肌痛的程度无关。未观察到其他主要副作用,也不需要减少剂量。在治疗开始后 1 个月,已在 17 名患者中研究了洛尼达明的药代动力学。在所有患者的血浆中都检测到氯尼达明,但氯尼达明水平与临床反应或毒性之间没有明确的关系。氯尼达明似乎对晚期乳腺癌有活性,其低毒性允许与化疗进行联合研究。
(2)报道二
LND 已被证明可以逆转对顺铂的耐药性并增强顺铂活性实验模型和临床研究。在一项紫杉醇、顺铂和氯尼达明在晚期卵巢癌中的II 期研究中,35 名连续的晚期卵巢癌患者,之前未接受过化疗,第 1 天静脉注射 (i.v.) 紫杉醇 135 mg/m2(3 小时输注),第 2 天静脉注射顺铂 75 mg/m2,外加口服 (p.o.) LND 450 mg/die,从化疗前两天开始连续 6 天,每 3 周一次,共 6 个周期。在 10 名有可测量疾病的女性中,有 8 名 (80%) 出现完全加部分反应。在25例可评估疾病的患者中,仅4例(16%)出现临床进展。中位无进展生存期(PFS)和总生存期(OS)分别为28.5(95%可信区间(CI)22.2–34.8)和46.5(95%CI 32.4–60.00)个月。9例(26%)患者出现3–4级中性粒细胞减少症。33例(94%)患者出现脱发,5例(14%)患者出现恶心呕吐(3级)。总之,CDDP/紫杉醇联合LND治疗晚期卵巢癌是有效且耐受性好的。
由于氯尼达明具体的作用机制和副作用与标准抗肿瘤药物的作用机制和副作用不重叠,因此已广泛研究将氯尼达明与标准化疗相结合用于治疗实体瘤。此外,氯尼达明增强放射治疗活性已被考虑用于转移性癌症病变的姑息治疗。治疗晚期乳腺癌、卵巢癌和肺癌的 II-III 期临床试验的令人鼓舞的结果必须通过更大规模的研究来证实。
4. 建议
与传统抗癌药物相比,氯尼达明提供了一种独特的治疗方法。传统的抗肿瘤药物一般作用于增殖细胞的细胞分裂,因而通常有骨髓抑制作用,并引起用药患者脱发、胸腺和脾萎缩以及消化道损伤等并发症,而且有时还有致突的促进作用。然而,氯尼达明与传统抗肿瘤药物的作用机制完全不同,它主要是抑制癌细胞中糖的代谢从而影响癌细胞的能量代谢,因而没有传统肮肿瘤药物的这些毒副作用。它针对癌细胞的能量代谢,有可能降低传统疗法中常见的耐药性风险。此外,氯尼达明与其他药物联合使用也显示出良好的前景,有可能降低这些药物的剂量和副作用。然而,对氯尼达明的研究仍在进行中,其自身的副作用和治疗方案需要进一步研究。
参考:
[1]https://www.nature.com/articles/s41467-019-10042-1
[2]https://www.sciencedirect.com/topics/chemistry/lonidamine
[3]https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1477623/
[4]https://europepmc.org/article/med/12730701
[5]https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5138080/
[6]https://www.sciencedirect.com/science/article/abs/pii/S0959804900004007
[7]https://www.nature.com/articles/bjc1991356
[8]https://go.drugbank.com/drugs/DB06266
[9]殷剑.抗肿瘤药氯尼达明的合成研究[D].南京理工大学,2014.