拉罗替尼是一种用于治疗癌症的药物,以品牌名称维特拉克维出售。它是一种抑制剂,可以抑制肌球蛋白激酶受体TrkA、TrkB和TrkC。拉罗替尼最早由阵列生物制药发现,并在2013年授权给Loxo肿瘤科。它最初被授予孤儿药状况,用于治疗软组织肉瘤,并在2016年获得了NTRK融合治疗转移性实体瘤的突破疗法称号。2018年11月26日,拉罗替尼获得了FDA的批准。
拉罗替尼是第一个专门开发并获准用于治疗任何包含某些突变的癌症的药物,而不仅仅是特定组织的癌症(即批准为“组织不可知“)。此前,一些药物最终被FDA批准用于治疗与癌症类型无关的特定突变,但这些药物最初是针对特定癌症类型开发的。FDA认为拉罗替尼是一流的药物。
拉罗替尼的作用靶点是NTRK融合的抗癌药,可以很好地抵抗多种携带突变的肠道癌症。它对许多肿瘤癌症有缓解的作用。希望大家也要多了解这些主要信息,然后患者可以根据这些基本的信息来用药。
拉罗替尼(Vitrakvi / Larotrectinib)是一种激酶抑制剂,适用于治疗符合以下条件的实体瘤:
1. 由某些异常神经营养性受体酪氨酸激酶(NTRK)基因引起的实体瘤,该实体瘤是转移性的或手术切除存在严重并发症的风险。
2. 没有令人满意的替代治疗或患者既往接受治疗后疾病进展。
对于所有实体瘤患者,携带NTRK融合基因的患者适用于拉罗替尼(Vitrakvi / Larotrectinib)治疗。可以通过下一代基因测序(NGS)或荧光原位杂交检测(FISH)来确定患者是否携带NTRK融合基因。下一代基因测序用于解析染色体的DNA序列,而荧光原位杂交检测用于定位染色体上的DNA序列。
拉罗替尼(Vitrakvi / Larotrectinib)是第一种获准用于治疗NTRK基因融合实体瘤的口服酪氨酸激酶抑制剂,适用于所有类型的实体瘤,无论其原发位置。NTRK基因融合是一种染色体异常,其形成于NTRK基因与另一段不相关的基因结合,而后转译并生成异常的TRK蛋白。TRK融合蛋白会引发癌细胞不受控制的增殖和生长。拉罗替尼能特异性清除NTRK融合基因,抑制TRK蛋白的生成,从而靶向性抑制癌细胞的增殖和生长。
标准剂量:体表面积超过1.0m2的患者每次口服100 mg,每日两次;体表面积不足1.0m2的儿童患者,日均推荐剂量为100 mg/m2。剂量可根据症状和既往副作用减少。在使用达克替尼(Vizimpro / Dacomitinib)治疗期间,应避免与强CYP3A4抑制剂、强CYP3A4诱导剂和敏感CYP3A4底物的药物相互作用。
药物处方指南中列出的常见不良反应包括疲劳、恶心、头晕、呕吐、天冬氨酸氨基转移酶(AST)升高、咳嗽、丙氨酸转氨酶(ALT)升高、便秘、腹痛等。
药物处方指南中列出的严重不良反应包括发热、腹泻、脓血症和脱水。
拉罗替尼是一种重要的制药物质,常被用于治疗特定疾病或症状。那么,在制药过程中,生产拉罗替尼需要哪些上游产品呢?本文将介绍相关信息。
在生产拉罗替尼的过程中,需要使用以下几种上游产品:
1. 原料药:原料药是制药过程中的关键组成部分,用于合成目标化合物。对于拉罗替尼的制药,可能需要使用一种或多种原料药进行合成反应。具体的原料药取决于制药厂商的工艺路线和专利技术。
2. 溶剂:在制药过程中,溶剂被用于溶解、反应和结晶等步骤。常见的溶剂包括水、有机溶剂如甲醇、乙醇等。溶剂的选择要考虑其溶解性、安全性和对反应的影响。
3. 催化剂:催化剂在合成过程中起到催化或促进反应的作用。对于拉罗替尼的生产,可能需要使用特定的催化剂来加速反应速率或选择性,提高产率和纯度。
4. 辅助剂:辅助剂在制药过程中用于调节反应条件和改善产品性质。例如,pH调节剂、表面活性剂、稳定剂等可以用于控制反应环境、增强制剂稳定性和延长产品的保质期。
需要注意的是,以上所提到的上游产品在拉罗替尼的制药过程中起到关键作用,但具体的配置和使用方式可能因制药厂商和工艺路线而有所不同。制药厂商会根据自身需求和实际情况选择合适的上游产品,并遵循相关的质量控制和合规要求。
综上所述,生产拉罗替尼所需的上游产品包括原料药、溶剂、催化剂和辅助剂等。这些上游产品在制药过程中起到重要的作用,对于生产高质量的拉罗替尼产品具有关键性意义。
许多癌症患者的病情变得复杂,放疗和化疗可能会产生副作用。靶向药物的出现为患者提供了更多选择和希望。然而,许多药物价格昂贵。那么拉罗替尼孟加拉版的价格是否更便宜呢?

拉罗替尼孟加拉版的价格备受关注,相对于正版药物,它确实更便宜。然而,并不会非常便宜,具体价格需要咨询相关地方以确定。
药品的销售价格受多种因素影响,例如汇率、生产厂家、规格和销售渠道等。因此,需要具体咨询以确定价格。在使用该药品之前,应在经验丰富的医生指导下开始,并进行相关检测。只有符合条件的患者才能使用。平时应了解正确的使用方式和剂量,因为每个患者的情况不同,使用时间和周期也不同。
以上是关于“拉罗替尼孟加拉版价格是否具有优势”的介绍。每个患者都有不同的选择和需求。一般建议根据实际情况选择和安排药品,并根据当前情况积极进行护理工作,避免错误用药,以免健康情况恶化并可能遇到新问题和危害。
来源:全球药直供
医药界近来掀起了一股风潮,前有基因编辑宝宝,后有广谱抗癌“神”药拉罗替尼(Larotrectinib,商品名Vitrakvi)。网络上一些消息如“治愈率高达75%”、“首个广谱抗癌药”、“异病同治”等关键词吸引了许多癌症患者的关注。
与以往的靶向药物最大的不同之处在于,拉罗替尼不是针对特定解剖位置的肿瘤,而是一种广谱肿瘤药物,适用于所有携带NTRK融合基因的成人或儿童实体瘤患者。
那么,拉罗替尼到底有哪些看点呢?它适用于哪些人群?它在临床上的表现如何?下面我们来一探究竟。
2018年11月,广谱抗癌靶向药拉罗替尼上市,被誉为“明星抗癌药”,受到全球患者的关注。它已经成为抗癌药物发展的一个重要趋势。
拉罗替尼是一种广谱抗癌药物,用于治疗携带NTRK基因融合的局部晚期或转移性实体瘤患者(重点是实体瘤且携带NTRK融合基因)。
与其他治疗方法不同的是,拉罗替尼是一种基于基因突变的独立治疗方法,它不关注癌症的种类,而是针对一种基因改变,即NTRK基因融合。这种基因改变存在于许多不同类型的肿瘤中,无论癌症起源于何处,拉罗替尼都可以发挥作用。
广谱抗癌药物拉罗替尼适用于携带NTRK基因融合的局部晚期或转移性实体瘤患者(重点是实体瘤且携带NTRK融合基因的患者)。此外,拉罗替尼不仅适用于成人,也适用于儿童。

根据2018年2月《新英格兰医学杂志》上发表的数据,拉罗替尼在55名可评估患者中的总有效率(ORR)为72%(95%可信区间,61%-85%)。
NHS首席执行官史蒂文斯在新闻稿中表示,尽管英国医护人员正日夜工作以应对全球冠状病毒大流行,但他们也在努力确保为其他患者提供最佳治疗。癌症治疗必须是优先事项,并且拉罗替尼是新一代药物中的第一种,可以治愈以前无法治疗的肿瘤。
1、肉瘤:
一名41岁的未分化肉瘤女患者,在接受拉罗替尼治疗前,肿瘤细胞已经广泛转移到肺部,患者面临呼吸困难和低氧血症的问题。经过LOXO-101 100mg BID治疗后,患者的呼吸困难和低氧血症得到了迅速缓解。两个周期后,大部分肿瘤消失,十二个周期后,肿瘤组织几乎完全消失。
2、儿童纤维肉瘤:
一名16个月大的婴儿患有纤维肉瘤,之前接受过3次手术和化疗,预后极差且易复发。通过基因检测发现ETV6-NTRK3突变后,开始接受LOXO-101 100mg BID /成人当量剂量的液体制剂治疗,三个周期后MRI显示肿瘤体积减少了90%。
3、分泌性乳腺癌:
一名患者之前接受过多次化疗和手术治疗,但肿瘤仍然复发且情况严重。通过基因检测发现ETV6-NTRK3融合后,使用LOXO-101治疗20天,肿瘤几乎消失。
由于该药在英国医院进行了实验,英国医生对其经验更为丰富。因此,在国内患者使用该药之前,可以通过国际远程会诊与英国权威肿瘤专家进行面对面的会诊,听取他们的意见,获取个性化的治疗方案。
Arkect与英国顶尖私人医生建立了官方合作,为中国患者提供一站式全程服务,让他们到英国就诊。在新冠肺炎时期,Arkect与英国顶级私人医生联合提供网上就诊服务,让中国患者享受英国顶尖医疗服务。快扫描下方二维码联系我们吧!
Larotrectinib(Vitrakvi,LOXO-101,拉罗替尼)是一种创新的抗癌药物,已获得美国FDA批准,用于治疗NTRK基因融合的成人和儿童局部晚期或转移性实体瘤患者。
自从2016年12月18日Loxo oncology公司的TRK抑制剂拉罗替尼(LOXO-101)在ESMO大会亚洲一期试验中展示出持久的抗肿瘤活性以来,就在肿瘤界引起了轰动。这一药物的批准标志着癌症治疗从“基于癌症在体内的起源”转向“基于肿瘤的遗传特征”的重要里程碑。

在试验中,拉罗替尼显示出对多种肿瘤类型的治疗效果,包括软组织肉瘤、唾液腺癌、婴儿纤维肉瘤、甲状腺癌、肺癌、黑素瘤、结肠癌、胃肠道间质瘤(GIST)、乳腺癌、骨肉瘤、胆管癌、原发性未知癌、先天性中胚层肾癌、阑尾和胰腺癌等。
只要进行基因检测,发现存在NTRK1、NTRK2或NTRK3基因融合,理论上都可以考虑使用拉罗替尼。
在一些罕见的癌症中,NTRK基因融合经常发生,如婴儿纤维肉瘤和分泌型乳房癌等。此外,其他许多肿瘤也发现存在NTRK基因融合,如急性髓性白血病、星形细胞瘤、脑低级别胶质瘤、乳腺癌、结直肠癌、先天性中胚层肾瘤、胃肠道间质瘤、多形性胶质母细胞瘤、头颈部鳞状细胞癌、肝内胆管细胞癌、肺癌、唾液腺来源的乳腺类似物分泌癌、黑色素瘤、肉瘤、分泌性乳腺癌和甲状腺癌等。
通常需要使用二代基因检测技术来检测基因融合,需要注意的是,这些融合事件是NTRK基因与其他基因融合的突变,而不是随机的点突变。
NTRK基因包括NTRK1、NTRK2和NTRK3,分别编码TRKA、TRKB和TRKC三种蛋白质,这些蛋白负责调控细胞生长和分化。当NTRK基因发生融合时,编码蛋白质会异常活化,从而促进肿瘤的发生。
已经有一些参与拉罗替尼临床试验的患者出现了耐药情况。研究发现,拉罗替尼的耐药机制与EGFR耐药机制相似,主要是由于靶点本身(TRK基因)产生了新的突变,如TRKA的G595R突变或TRKC的G623R突变。为了应对这一问题,第二代TRK靶向药物LOXO-195已经问世,专门用于对抗耐药突变,以重新压制肿瘤的生长。LOXO-195已获得FDA批准,正式开展临床试验,为耐药患者带来新的希望。
动物模型显示,抑制TRK功能可能会引起明显的神经毒性,如运动失调(共济失调)、感觉异常和行为异常等。然而,在拉罗替尼的临床试验中,尚未发现任何明显的严重毒副作用。在药物开发过程中,科学家们针对性地进行了大量优化,希望在保持肿瘤疗效的同时,减少对神经系统的毒副作用。例如,他们减弱了拉罗替尼通过血脑屏障的能力,以减少对大脑的影响。
拉罗替尼(Vitrakvi)是一种针对携带NTRK基因融合的局部晚期或转移性实体瘤的成人和儿童患者的治疗药物。它在17种肿瘤中的有效率高达75%!与“抗癌神药”PD-1的有效率仅为20~30%相比,拉罗替尼的优势何在呢?下面我们将从几个方面来了解一下拉罗替尼:
拉罗替尼的批准是基于三个多中心、开放标签、单臂临床试验(loxo-trk-14001、scout和navigate)的数据。这些数据通过下一代测序或荧光原位杂交在当地实验室前瞻性地确定了NTRK基因融合的阳性状态。
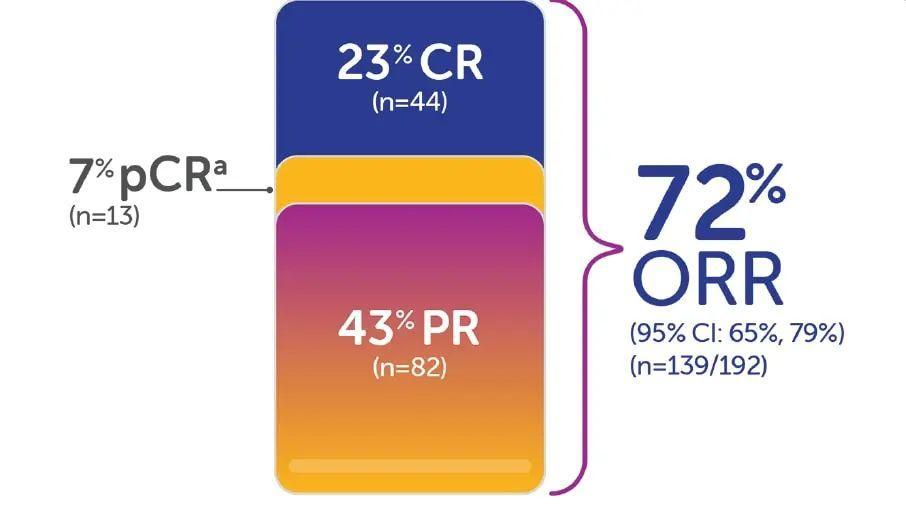
对于前55名患有不可切除或转移性实体肿瘤的患者进行了功效评估(这些实体肿瘤中有NTRK基因融合体),其中包括12名年龄不到18岁的患者,共涉及12种癌症类型,最常见的是唾液腺肿瘤(22%)和软组织肿瘤(20%)。其他类型包括婴儿纤维肉瘤(13%)和甲状腺癌(9%)。总有效率为75%,其中包括22%的完全缓解和53%的部分缓解。73%的患者缓解持续时间为6个月或更长,63%的患者缓解持续时间为9个月或更长,39%的患者缓解持续时间为12个月或更长。
Larotroctinib是一种原肌球蛋白受体激酶(TRKs)trkA、trkB和trkC的抑制剂。这些受体由基因NTRK1、NTRK2和NTRK3编码,它们与不同伙伴的基因帧融合可导致组成性激活,形成嵌合TRK融合蛋白,从而促进肿瘤细胞的增殖和存活。而Larotroctinib可以抑制原肌球蛋白受体激酶,从而抑制肿瘤细胞的增殖和存活。
对于体表面积(≥1.0㎡)的成人患者和儿童患者,推荐的拉罗替尼剂量为每天两次口服100mg。对于体表面积(<1.0㎡)的儿童患者,推荐的拉罗替尼剂量为每天两次口服100mg每平方米(最大剂量为每剂100mg)。
治疗应持续到疾病进展为止或不可接受的毒性。对于中度或重度肝损伤患者,起始剂量应减少50%。
在三个单臂临床试验中,对176名患者进行了拉罗替尼的安全性评估(其中包括44名儿科患者)。
最常见的不良反应(≥20%的患者)包括呕吐、恶心、头晕、咳嗽、便秘和腹泻。
51%的患者出现3级或4级不良反应,53%的患者出现任何级别的神经不良反应。神经不良反应包括精神错乱、构音障碍、头晕、步态障碍和感觉异常。
最常见的3级或4级实验室异常为贫血和中性粒细胞减少。
最常见的严重不良反应包括发热、腹泻、败血症、腹痛、脱水、蜂窝组织炎和呕吐。
拉罗替尼具有神经毒性、肝毒性和胚胎胎儿毒性的警告/预防作用。
应告知患者和护理人员有关神经系统不良反应的风险,并建议不要驾驶或母乳喂养。
https://www.ascopost.com/issues/december-25-2018/larotrectinib-for-solid-tumors-with-ntrk-gene-fusions/
https://www.ascopost.com/News/59498
2022年ESMO世界胃肠癌大会上发布了一项关于拉罗替尼治疗TRK融合阳性胃肠道癌症的最新长期数据。研究结果显示,在TRK融合阳性的局部晚期或转移性胃肠癌患者中,拉罗替尼产生了持久的治疗反应,尤其是在结直肠癌患者中表现出较好的效果。
该研究是一项II期临床试验,招募了年龄≥12岁的局部晚期或转移性实体肿瘤患者,这些患者的肿瘤中含有NTRK1、NTRK2或NTRK3基因融合。NTRK融合状态是通过当地CLIA认可的实验室或类似实验室进行确定的。患者入组的条件还包括已接受标准治疗或没有满意的替代治疗。入组后,所有患者接受每日两次100 mg的拉罗替尼治疗。研究的主要终点是根据RECIST v1.1标准评估的总缓解率(ORR),次要终点包括缓解持续时间(DOR)、无进展生存(PFS)和总生存(OS)。具体的研究设计见图1。

截至2021年7月20日,共有34例患者符合评估条件,其中包括结直肠癌(19例)、胰腺癌、胆管癌、阑尾癌、胃癌、肝癌、食管癌等胃肠道肿瘤。所有患者的中位年龄为63.5岁(范围:32~90岁)。其中大多数患者为女性(62%),ECOG表现状态为1(65%),曾接受过全身治疗(85%),且曾接受过手术(82%)。就既往接受全身方案治疗而言,15%的患者既往未接受过一线治疗,32%的患者既往接受了一线治疗,35%的患者既往接受了二线治疗,18%的患者既往接受了三线及以上的治疗。
研究结果显示,在接受拉罗替尼治疗的34例患者中,总缓解率(ORR)为33%,其中完全缓解(CR)率为3%,部分缓解(PR)率为30%。此外,45%的患者病情稳定。这意味着,78%的患者的病情得到了控制,病灶缩小甚至完全消失。值得一提的是,在19名结直肠癌患者中,总缓解率(ORR)高达47%,完全缓解率(CR)为5%,这意味着近一半的结直肠癌患者的病情得到了显著缩小甚至消失。此外,42%的患者病情稳定,疾病控制率达到了89%。
Garralda E, Hong DS, Xu R, et al. Long-term efficacy and safety of larotrectinib in patients with tropomyosin receptor kinase (TRK) fusion gastrointestinal (GI) cancer: an expanded dataset. Ann Oncol.2022;33(suppl 4):S370. doi:10.1016/j.annonc.2022.04.430.
原文链接:点击查看
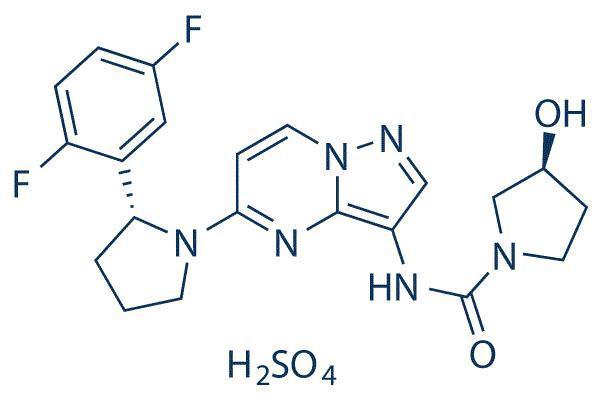
拉罗替尼(Larotrectinib)是由Array BioPharma公司研发、由拜耳公司与LoxoOncology公司共同临床开发的一种选择性原肌球蛋白受体激酶(TRK)抑制剂,是一种广谱抗癌药。目前,Larotrectinib的制备通常是先合成其关键手性中间体(R)-2-(2,5-二氟苯基)吡咯烷,再利用 (R)-2-(2,5-二氟苯基)吡咯烷继续合成,最终制得Larotrectinib.
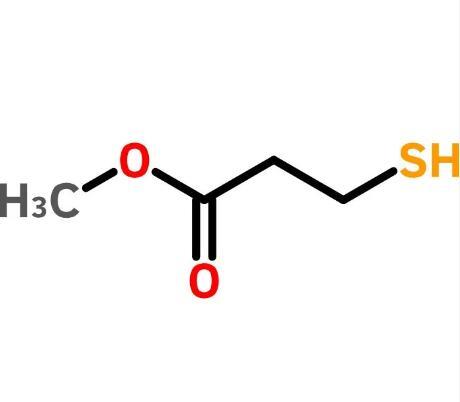
目前,合成中间体(R)-2-(2,5-二氟苯基)吡咯烷主要有化学合成法和生物合成法两类:
化学合成法主要是通过有机合成手段合成(R)-2-(2,5-二氟苯基)吡咯烷。WO2010048314A1报道在低温条件下用醋酸钯和手性诱导剂(-)-sparteine诱导合成(R)-2-(2,5-二氟苯基)吡咯烷,但是该方法使用贵金属作为催化剂,成本较高,且存在污染环境等问题,因此不适用于大规模工业化生产.
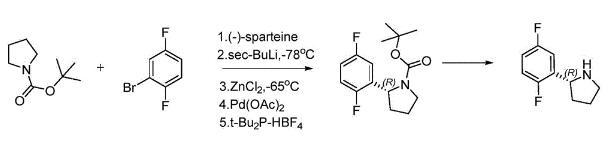
CN107286070A采用手性试剂(S)-叔丁基亚磺酰胺及其类似物和格式试剂合成(R)-2-(2,5-二氟苯基)吡咯烷,格式试剂反应属于剧烈反应,对温度、加料速度以及物料和设备的干燥性均有严格要求,若未能有效控制上述参数,则可能造成反应失控,引起火灾爆炸事故,因此亦不适用于大规模工业化生产.
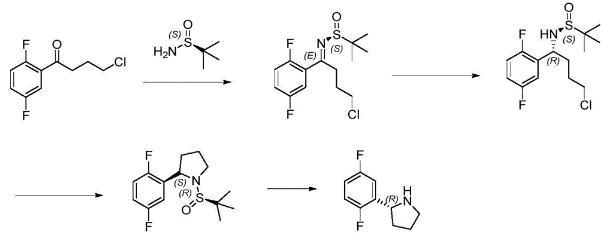
生物合成法主要利用生物酶催化反应合成(R)-2-(2,5-二氟苯基)吡咯烷。CN108484361A利用羰基还原酶或醇脱氢酶先合成(S)-4-氯-1-(2,5)-二氟苯基丁-1-醇,再构型翻转合成(R)-2-(2,5-二氟苯基)吡咯烷.
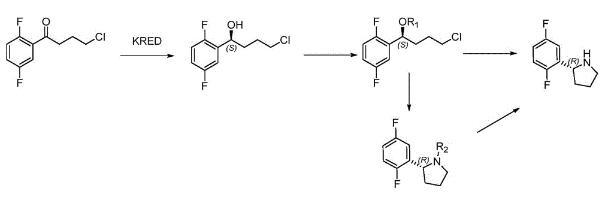
CN114075557A
近年来,多种靶向免疫治疗药物已经开始挑战“实体瘤”广谱抗癌适应症。这些药物基于TMB、MSI、NTRK1/2/3、BRAF等分子标记获得了相应适应症。那么,第六个不限癌肿广谱适应症是什么呢?
2022年9月22日,美国FDA加速批准了selpercatinib (塞尔帕替尼 Retevmo)的上市,该药物用于全身治疗失败后的晚期或转移性RET融合实体瘤患者。
2017年5月,帕姆单抗(pembrolizumab)被美国FDA批准用于无论肿瘤来源的高微卫星不稳定性(MSI-H)或错配修复缺陷(dMMR)的实体肿瘤患者,成为全球首个不区分肿瘤来源的免疫药物。
2018年11月,拉罗替尼(larotrectinib)被美国FDA批准用于具有神经营养受体酪氨酸激酶(NTRK)基因融合的成人和小儿实体瘤治疗。
2019年8月,恩曲替尼(Entrectinib)被FDA加速批准用于治疗成人和儿童患者神经营养原肌球蛋白受体激酶(NTRK)融合阳性、初始治疗后局部晚期或转移性实体肿瘤进展或无标准治疗方案的实体瘤患者,以及ROS1阳性非小细胞肺癌(NSCLC)患者。
2020年6月,帕姆单抗(pembrolizumab)获得第二个“不限癌种”的新适应症批准。该药物用于治疗具有高组织肿瘤突变负荷(TMB-H)≥10个突变/Mb(使用FDA指定的检测)的无法切除或转移性实体瘤的成年和儿科患者。
2022年06月23日,达拉非尼联合曲美替尼被美国FDA加速批准用于携带BRAF V600E突变、不可切除或转移性实体瘤的6岁及以上儿童和成人患者,这些患者在先前的治疗后出现进展且没有其他治疗方案。
其中,两款广谱抗癌药物已经在国内获得批准!
2022年4月13日,中国NMPA批准了靶向药物硫酸拉罗替尼胶囊(商品名:维泰凯)的上市,该药物用于治疗经充分验证的检测方法诊断为NTRK基因融合且无已知获得性耐药突变,局部晚期、转移性或手术切除可能导致严重并发症,没有令人满意替代治疗方案或既往治疗失败的泛实体瘤成人和儿童患者。中国迎来了首个与肿瘤/组织无关的泛实体瘤靶向药物:拉罗替尼。
2022年7月29日,罗氏制药的Entrectinib(恩曲替尼)获得国家药品监督管理局(NMPA)正式批准,适用于经充分验证的检测方法诊断为携带神经营养酪氨酸受体激酶(Neurotrophic tyrosine receptor kinase,NTRK)融合基因且不包括已知获得性耐药突变,患有局部晚期、转移性疾病或手术切除可能导致严重并发症,以及无满意替代治疗或既往治疗失败的成人和12岁及以上儿童实体瘤患者。
2022年9月22日,美国FDA加速批准了selpercatinib (塞尔帕替尼 Retevmo)的上市,该药物用于全身治疗失败后的晚期或转移性RET融合实体瘤患者,成为了第六项基于分子标记却不限癌种的获批适应症!同时,塞尔帕替尼也是首个被批准专门用于治疗携带RET基因变异实体瘤的精准疗法。
2023年12月13日,《国家基本医疗保险、工伤保险和生育保险药品目录》如期更新,作为重点关注领域,抗肿瘤治疗领域的创新药物可及性持续提升,多款重磅药物被纳入医保,惠及更多患者。
恩曲替尼作为一种靶向ROS1和NTRK,且具有中枢神经系统(CNS)抗肿瘤活性的新一代强效酪氨酸激酶抑制剂(TKI),于2022年在我国正式获批用于NTRK融合阳性局部晚期或转移性实体瘤,以及ROS1阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。在本次医保目录更新中,恩曲替尼两项适应症双双纳入医保目录。同时,恩曲替尼在《2023 CSCO非小细胞肺癌诊疗指南》中被推荐为NTRK融合阳性和ROS1融合阳性患者一线治疗的一级推荐。
既往医保中,治疗ROS1融合阳性的药物仅有克唑替尼一款,患者在用药选择方面有一定的局限性。根据2023年WCLC的最新研究结果,对于亚洲ROS1阳性NSCLC患者,恩曲替尼作为一线治疗的药物,其mPFS达到了39.4个月。与克唑替尼相比,恩曲替尼能够显著降低疾病进展或死亡的风险,降低幅度为31.2%,同时能显著降低死亡风险,降低幅度为33.8%.
此次恩曲替尼纳入医保,将为ROS1融合阳性患者提供更多的药物选择,为那些由于价格原因选择克唑替尼的患者提供更为有效的治疗。
目前,我国上市的NTRK靶向药物有拉罗替尼和恩曲替尼,既往医保中并未有针对NTRK融合阳性的药物。NTRK被认为是预后较差的标志,未靶向治疗的NTRK融合阳性实体瘤患者的OS仅为10.2~12.7个月。
恩曲替尼在2023 ESMO中公布的最新数据显示,对于纳入的17种不同实体瘤类型的患者,恩曲替尼治疗后的中位OS达到了38.2个月。虽然临床上并未有研究真实对比二者的疗效,但此次恩曲替尼进入医保,从价格方面完胜拉罗替尼。