氯代仲丁烷是一种有机氯化合物,化学式为C4H9Cl。它是无色挥发性液体,有卤代烃的气味。氯代仲丁烷可由2-丁醇在氯化锌的存在下和浓盐酸反应得到,此外,在三苯基膦的存在下,四氯化碳也可作为氯化试剂,将2-丁醇转化为2-氯丁烷。氯代仲丁烷和叠氮化钠在二甲基甲酰胺中反应,可以得到2-叠氮基丁烷。氯代仲丁烷和镁在乙醚中反应,可以得到2-丁基氯化镁;和锂反应,得到2-丁基锂。是常见的医药化工中间体。

图1 氯代仲丁烷的性状图
参考文献[2]公开了一种氯代仲丁烷的合成方法,步骤一、将仲丁醇和浓度为30%盐酸溶液连续滴加到反应釜1中反应,反应温度为95℃,仲丁醇和盐酸溶液的加入流量分别为1和5;步骤二、反应的同时,在反应釜1顶部收集混合物蒸汽,通过第一冷凝器5将混合物蒸汽经降温到76℃,形成混合溶液进入分馏器2分馏,分馏得到分馏后蒸汽,混合物蒸汽中的仲丁醇在分馏器冷却至液体;分馏器2与反应釜1连通,将分馏得到的仲丁醇回流到反应釜1。其中分馏器2的进料管7加热至65℃,使得氯代仲丁烷在进料管内即蒸馏出去。步骤三、分馏后蒸汽中的水和氯代仲丁烷分通过第二冷凝器6进行降温至48℃,进入脱轻罐3脱轻得到脱轻液,脱轻温度为38℃;脱轻得到的轻组分返回至反应釜1抑制副反应。步骤四、脱轻液进行水洗,去除水容物,然后进入脱水罐4脱水,得到粗产品;脱水温度为68℃,其中脱水时的蒸汽冷凝后静置分层,上层也返回脱水罐4;步骤五、粗产品精馏得到氯代仲丁烷,精馏温度为70℃。本实施例制得的氯代仲丁烷收率为90.3%,纯度为99.6%。
[1]R.Karl.Product subclass1: Lithiumm etal.Science of Synthesis,2006.8a.43-132.CODEN:SSCYJ9.
[2]一种氯代仲丁烷的合成方法.CN113501744A.
正丁烷是一种具有天然气气味的无色麻醉性气体,在常温常压下极易燃烧,能与空气形成爆炸性混合物。它主要用于有机合成、乙烯制造、燃料、溶剂、制冷剂、标准气、校正气、烟雾喷射剂、标准蒸气压型压力表和电离粒子计数器。
正丁烷通过自由基取代反应生成各种氯代丁烷。取代时,两种氢原子的取代速率不同,这是因为两种C-H键键能不同,归根结底是因为生成的两种自由基稳定性不同。在2-位取代生成的仲丁基自由基较稳定,因此该种氢较易被取代。
正丁烷的爆炸极限是1.6%至8.5%(体积),异丁烷的爆炸极限是1.9%至8.4%(体积)。
正丁烷广泛用于家庭取暖、炊事和工业加热,与丙烷混合作为液化石油气。此外,它还用作有机合成原料,制造橡胶、液体燃料、马达燃料掺和物、重油精制脱沥青剂、油井中蜡沉淀溶剂等。
另外,正丁烷也用于有机合成、乙烯制造、家用燃料、溶剂、制冷剂、仪器校正等领域。
一种正丁烷的制备方法是以碳四烷烃为原料,经过脱轻塔、丁烷塔分离异丁烷、正构化反应器反应得到粗正丁烷、脱重塔除去碳四重组分最终得到质量分数为97.5~99%的正丁烷产品。
丁烷,又称正丁烷,是一种有机化合物,其分子式为C4H10,结构式为CH3CH2CH2CH3。它是一种无色、易液化、易燃的气体,在常温常压下存在。
丁烷最早由英国化学家爱德华·弗兰克兰德于1849年发现。

当丁烷在充足的氧气条件下燃烧时,会产生二氧化碳和水蒸气。

如果氧气不足,丁烷的燃烧会产生水蒸气和碳(炭黑)或一氧化碳。

丁烷在空气中燃烧的最高火焰温度为2243 K(1970 °C)。
丁烷是石油裂化反应的产物之一。它被广泛用作家用液化石油气,并用于打火机和便携式丁烷气炉中作为燃料。
正丁烷还是杜邦法合成马来酸酐的原料,该反应使用焦磷酸钒酰((VO)2(P2O7))作为催化剂。

此外,丁烷还可以用于合成丁烯、二硫化碳等化合物。
正丁烷可以通过自由基取代反应生成各种氯代丁烷。在取代反应中,两种氢原子的取代速率不同,这是因为两种C-H键的键能不同,最终是由于生成的两种自由基的稳定性不同。2-位取代生成的仲丁基自由基较稳定,因此该位置的氢较容易被取代。
正丁烷的爆炸极限是1.6%至8.5%(体积),而异丁烷的爆炸极限是1.9%至8.4%(体积)。
噻唑磷是一种重要的有机磷杀虫剂和杀菌剂,广泛应用于农业领域,以保护作物免受害虫和病原菌的侵害。本文将详细探讨噻唑磷的合成路线、涉及的化学反应以及其在农业中的实际应用,帮助读者全面了解这一重要化合物的制备和用途。
简述:
噻唑磷,通用名:fosthiazate,化学名称:(R,S)-S-仲丁基-O-乙基-2-氧代-1,3-噻唑烷-3-基硫代磷酸酯,1985年由日本石原公司开发成功,并作为一种新颖、高效、广谱性的非熏蒸型有机磷杀虫、杀线虫剂,已在日本等许多国家投放市场。
噻唑膦是一种新颖、高效低毒、广谱性的非熏蒸型有机磷杀线虫杀螨和土壤杀虫剂,具有强烈的触杀活性,对多种线虫、昆虫和螨类有明显的内吸毒杀作用,并对传统杀虫剂已产生抗性的一些害虫,也有很高的活性,在国家发布实施的淘汰中高毒农药中,属于国家鼓励的高毒农药替代品种。
1. 合成
先将2-噻唑烷酮与O,O'-二乙基硫代磷酰氯进行缩合反应生成O,O'-二乙基-2-氧代-1,3-噻唑烷-3-基硫逐磷酸酯,该硫逐磷酸酯再与二甲胺反应生成相应硫代磷酸酯铵盐,然后与溴代仲丁烷进行烷基化反应得到噻唑磷。反应总收率达到36%,产品含量大于80%。具体如下:
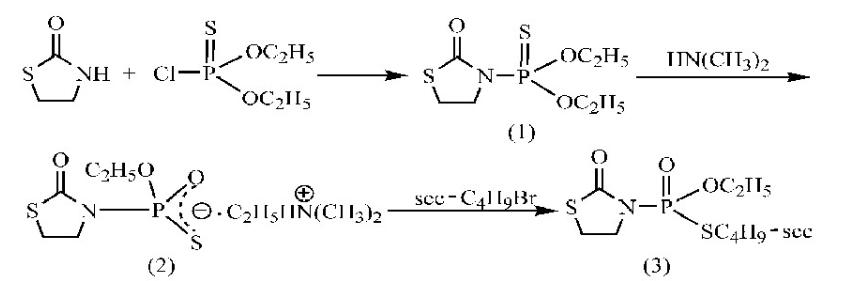
(1)O,O'-二乙基-2-氧代-1,3-噻唑烷-3-基硫逐磷酸酯(1)的合成
在500ml四口烧瓶中,加入0.3mol 2-噻唑烷酮、0.3mol三乙胺和200ml甲苯,电动搅拌。加热至80℃,滴加0.36mol O,O'-二乙基硫代磷酰氯。滴加完毕,继续加热至100℃,保温反应4h。反应结束,冷却至室温,水洗,甲苯层用无水硫酸钠干燥,过滤,脱溶并减压蒸馏得到73.1g棕黄色油状液体O,O'-二乙基-2-氧代-1,3-噻唑烷-3-基硫逐磷酸酯。含量96.5%,收率92.2%。Ms m/z(relative intensity):255(M+,29),227(98),199(85),168(11),154(30),121(100),102(13),97(50),93(35),65(28),44(27)。
(2)噻唑磷(3)的合成
在250ml四口烧瓶中加入上述O,O'-二乙基-2-氧代-1,3-噻唑烷-3-基硫逐磷酸酯(以0.276mol计)与82.5ml(0.55mol)33%二甲胺水溶液。电动搅拌,加热至回流,保温反应20h。停止反应,反应液浓缩,得到78.1g浅黄色粘稠状的硫代磷酸酯铵盐(2)。
将上述硫代磷酸酯铵盐加入到250ml四口烧瓶中,加入120ml甲苯及适量相转移催化剂,搅拌升温至回流。在20min内滴加37ml(0.33mol)溴代仲丁烷,滴加完毕,继续在回流条件下反应1 0 h。反应结束,水洗分层,甲苯层用无水硫酸钠干燥。过滤,滤液浓缩,得37.1g棕黄色油状噻唑磷。含量82.0%,收率39.0%(以O,O'-二乙基-2-氧代-1,3-噻唑烷-3-基硫逐磷酸酯计)。IR v(cm-1):2968,1697,1286,1251,967,602;1H NMR(CDCl3)δ:1.00~1.04(m,3H,-CHCH2CH3),1.37~1.46(m,6H,-OCH2CH3,-CHCH3),1.67~1.74(m,2H,-CHCH2CH3),3.36~3.45(m,2H,-SCH2-),3.47~3.55(m,1H,-CH),4.03~4.14(m,2H,-OCH2),4.21~4.29(m,2H,-NCH2-);Ms m/z(relative intensity):283(M+,40),255(13),228(71),195(100),166(42),139(28),126(49),104(69),59(31),45(28)。
2. 新型应用研究
噻唑磷与铜氨络合物鸡尾酒疗法治疗柑橘黄龙病。黄龙病(HLB)是一种由亚洲利贝里杆菌(Ca.Las)引起的破坏性柑橘细菌性病害,目前的农药无法治愈。在受HLB感染的柑橘树根部观察到根部病变和半穿刺线虫幼虫。Jingwei Duan等人用噻唑膦(FOS)和铜铵复合物(CAC)进行根部处理将改善根部生长并抑制HLB。CAC是一种广谱杀菌剂,可以促进作物生长。FOS可以杀死半穿刺线虫并保护根部免受Ca.Las等有害细菌的伤害。通过根部灌注FOS和CAC联合治疗90天后,柑橘长出了新根并且其叶子变绿。Ca.Las的抑制率达到90%以上。处理过程中叶绿素含量和根系活力分别增加了396%和151%,淀粉积累减少了88%。透射电镜和植物组织染色实验表明,感染HLB的叶片叶绿体类囊体系统中存在更多不规则肿胀的淀粉颗粒,这是由于淀粉阻塞了它们的分泌组织所致。体外TEM和流式细胞术实验表明FOS和CAC存在协同作用,转录组分析表明处理诱导了涉及103条代谢途径的基因的差异表达。这些结果提示FOS和CAC的鸡尾酒处理可有效杀死柑橘根部包括Ca.Las在内的多种病原菌,从而有效防治HLB。
参考:
[1]吕明永, 50 吨/年噻唑磷原药的合成技术及产业化. 山东省, 山东华阳农药化工集团有限公司, 2014-08-12.
[2]翁建全,沈德隆,谭成侠. 异构化法合成噻唑磷 [J]. 农药, 2006, (08): 527-528. DOI:10.16820/j.cnki.1006-0413.2006.08.008.
[3]Duan J, Li X, Zhang J, et al. Cocktail therapy of fosthiazate and cupric-ammoniun complex for citrus huanglongbing[J]. Frontiers in Plant Science, 2021, 12: 643971.
甲基锂是一种常用的有机金属试剂,具有广泛的应用领域。它可以用于多种官能团的甲基化、脱除保护基团或合成其他甲基化有机金属试剂。此外,甲基锂还可以作为碱和还原过渡金属等。
与甲基格氏试剂相比,甲基锂与环烃、杂环、脂肪族化合物的1,2-加成反应有不同的选择性。它与酮的亲核加成由于螯合反应而有高的非对映选择性。Lewis酸对该反应的立体选择性也有显著的影响。

将甲基锂转化为有机钛、有机铈或者有机锌后,可以提高其立体选择性。例如,将甲基锂转化为手性钛与苯甲醛发生1,2-加成,产物的立体选择性可以达到99% ee。

甲基锂与酸和酯作用可以得到甲基酮,而用三甲基氯硅烷对该反应进行后处理可得到更好的结果。对于用烷氧羰基和苯甲酰基保护的仲酰肼来说,甲基锂是一个很好的脱酰基试剂。将甲基锂和溴化锂一起与甲硅烷基酮在0°C作用,可以高度立体选择性地得到甲硅烷基烯醇醚。

腈、亚胺以及唑烷都可以作为碳氮不饱和键的1,2-加成的底物。例如,在异丙基苯/THF中,甲基锂与保护的氰醇加成,水解后得到很高产率的甲基甾族酮。而四嗪、吡嗪等芳香杂环的加成反应就很难进行。在具有C2对称性的叔二胺的催化下,芳香亚胺可以与甲基锂发生对映选择性的加成。

甲基锂还可以与邻烯丙基苯甲酰胺成环生成萘酚衍生物。此外,甲基锂可以使环丙基衍生物的偕二溴化物发生重排,得到丙二烯衍生物和一溴取代物的混合物。与偕二溴代环丁烷作用后,甲基锂可以脱除溴并重排得到亚烷基环丙烷。

这篇文章将介绍合成一种名为3S)-3-(叔丁氧羰基)氨基-1-氯-4-苯基-2-丁酮的方法,该方法可能涉及多步合成和化学反应。通过详细阐述合成路径和关键步骤,有助于读者了解该化合物的制备过程和相关化学原理。
背景:硫酸阿扎拉韦是由瑞士诺华公司研制的全球首个每日一次给药的蛋白酶抑制剂,后授权给德国百时美施贵宝公司。该药物于2003年6月首次在美国上市,能持续强效地抑制艾滋病病毒,与其他抗病毒药物联合应用于艾滋病的抗病毒治疗,具有抗病毒作用强、耐药性低、代谢副作用小等特点。
目前硫酸阿扎拉韦的典型合成方法是以(2R,3S)- 4-苯基-1,2-环氧-3-叔丁氧羰基氨基丁烷(1)和 2-[4-(2-吡啶基)苄基]-肼羧酸叔丁酯为起始原料,经缩合、脱保护、成盐、中和,再酰胺化和成盐等反应制备。然而,目前该关键中间体的合成路线中起始原料和生物酶等不易得,价格昂贵,且安全性较差。因此,有研究对硫酸阿扎拉韦关键中间体的合成路线进行了改进和优化。采用了廉价的L-苯丙氨酸(2)为起始原料,与二碳酸二叔丁酯进行 N-Boc保护后,与二氯亚砜进行酰氯化,再在新制的醇镁作用下与丙二酸二乙酯发生取代反应后再脱羧和氯代,“一锅法”制得(S)-4-苯基-3-(叔丁氧羰基)氨基-1-氯-2-丁酮(6),6经异丙醇铝还原后再环合即制得化合物1。

合成:
将19.9 g(75 mmol)化合物3和60 mL甲苯加 入反应瓶中,再加入21.5 mL(300 mmol)二氯亚砜, 3~5滴N,N-二甲基甲酰胺(DMF),加热搅拌,升 高反应温度至65℃,并在此温度下搅拌反应50 min,TLC[展开剂:V(石油醚)∶V(乙酸乙酯)=4∶1]跟踪反应进程。反应结束后减压蒸去过量的二氯亚砜和溶剂,得21.0 g淡黄色油状物4,加入20 mL甲苯 混合待用。
将2.0 g(83 mmol)镁屑和15 mL无水乙醇加入反应瓶中,滴加几滴四氯化碳,搅拌升温至55~ 60℃,反应0.5 h,再滴加含有13.3 g(83 mmol) 丙二酸二乙酯和30 mL甲苯的混合溶液,滴完后,升温至70℃反应至镁完全溶解,减压蒸去乙醇,将20 mL甲苯加入,制得灰色试液。将该灰色试液冷却至5~10℃,将上述得到的化合物4的甲苯溶液滴入,滴完后升至室温并搅拌反应2 h,TLC [展开剂:V(石油醚)∶V(乙酸乙酯)=5∶1]跟踪反应进程。反应结束后分别用80 mL饱和Na2CO 3和饱和食盐水分2次洗涤有机层,合并有机层并干燥,减压蒸除溶剂得黄色油状液体;向该黄色油状液体中加入30 mL冰醋酸、15 mL水和7 mL浓硫酸,升温至回流反应5 h,停止反应,冰水冷却,慢慢加入150 mL 10%氢氧化钠溶液,过滤,滤液用乙酸乙酯(15 mL×3)萃取,合并有机相,用饱和氯化钠溶液、纯化水各50 mL洗涤,无水硫酸钠干燥后减压浓缩得到淡黄色油状物5。向5中加入 150 mL乙酸乙酯,搅拌混合均匀,室温下将 150 m L 6 mol·L- 1盐酸滴入,滴完后继续搅拌反应 2 h,停止反应,静置后分出有机层,用150 mL乙酸乙酯分3次萃取,合并有机层后再分别用饱和食盐水和蒸馏水各100 mL洗涤,干燥后减压蒸去溶剂得浅黄色油状液体,向该液体中加入150 mL石油醚,加热回流至澄清,冷却静置,析出大量固体,抽滤析出的固体,干燥得15.7 g类白色粉末状固体6即(S)-4-苯基-3-(叔丁氧羰基)氨基-1-氯-2-丁酮,收率70.4%(以3计)。
参考文献:
[1]刘志,仲金璐,陈成等.抗HIV药物硫酸阿扎那韦关键中间体的合成工艺研究[J].精细化工中间体,2020,50(06):45-48+60.DOI:10.19342/j.cnki.issn.1009-9212.2020.06.011.
[2]刘念,杨永生,向永等. 生物酶催化不对称合成阿扎那韦中间体[C]//中国化学会产学研合作与促进委员会,重庆市科学技术委员会.化学与创新药物——2013年中国化学会产学研合作研讨会会议论文集.化学与创新药物——2013年中国化学会产学研合作研讨会会议论文集,2013:69.
【英文名称】 Methyllithium
【分子式】CH3Li
【分子量】21.98
【CAS号】917-54-4
【物理性质】甲基锂通常以溶液的形式存在和使用,常见的溶剂有乙醚和THF。它不溶于烃类溶剂,与水和其他质子性溶剂反应会生成甲烷。
【制备和商品】国际大型试剂公司有销售甲基锂,常见的商品有含有1.0eq LiBr的1.4 mol/L和1.5 mol/L乙醚溶液。
【注意事项】甲基锂具有很高的可燃性。在没有LiBr的情况下,乙醚中的甲基锂容易自燃,因此在使用时需要在惰性气体保护下进行,并在通风橱中操作。
甲基锂可以用于多种官能团的甲基化、脱除保护基团或合成其他甲基化有机金属试剂,还可以作为碱和还原过渡金属等。甲基锂的反应受所用溶剂和卤素类型的影响。
加成反应方面,甲基锂与环烃、杂环和脂肪族化合物的1,2-加成反应具有不同的选择性。它与酮的亲核加成由于螯合反应而具有高的非对映选择性。该反应的立体选择性还受到Lewis酸的影响。

把有机锂转化为有机钛、有机铈或者有机锌后可以提高其立体选择性。例如,将甲基锂转化为手性钛与苯甲醛发生1,2-加成,产物的立体选择性可以达到99% ee。

甲基锂与酸和酯反应可以得到甲基酮,而用三甲基氯硅烷对该反应进行后处理可以得到更好的结果。对于用烷氧羰基和苯甲酰基保护的仲酰肼来说,甲基锂是一个很好的脱酰基试剂。将甲基锂和溴化锂一起与甲硅烷基酮在0°C作用,可以高度立体选择性地得到甲硅烷基烯醇醚。

腈、亚胺以及唑烷都可以作为碳氮不饱和键的1,2-加成的底物。例如,在异丙基苯/THF中,甲基锂与保护的氰醇加成,水解后可以得到很高产率的甲基甾族酮。而四嗪、吡嗪等芳香杂环的加成反应则很难进行。在具有C2对称性的叔二胺的催化下,芳香亚胺可以与甲基锂发生对映选择性的加成。

甲基锂还可以与邻烯丙基苯甲酰胺成环生成萘酚衍生物。

甲基锂可以使环丙基衍生物的偕二溴化物发生重排,得到丙二烯衍生物和一溴取代物的混合物。甲基锂还可以与偕二溴代环丁烷作用,脱除溴后重排得到亚烷基环丙烷。

参考文献:
1. Maruoka, K.; Itoh, T.; Sakurai, M.; Nonoshita. K;Yamamoto, H. J. Am. Chem. Soc. 1988,110, 3588.
2. (a) Reetz, M. T.; Kyung, S. H.; Huellman, M. Tetrahedron 1986,42,2931. (b) Rcetz, M. T.; Hugel, H.;
Dresely, K. Tetrahedron 1987, 43,109.
3. Reich, H. J.; Holtan, R. C.; Bolm, C.J. Am. Chem. Soc. 1990,112,5609.
4. (a) Kizirian, J. C.; Caille, J, C.; Alexakis, A. Tetrahedron Lett 2003, 441 8893. (b) Kizirian, J. C.;
Cabello, N.; Pinchard, L.; Caille, J. C.; Alexakis, A. Tetrahedron 2005, 61,8939.
5. Sibi, M. P.; Dankwardt, J. W.; Snieckus, V. J. Org, Chem. 1986,51, 271.
6. Nordvik, T.; Mieusset, J. L.; Brinker, U. H. Org. Lett 2004,6,715.